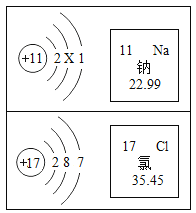
题目内容
【题目】将碳酸钠和碳酸氢钠的混合物20g充分加热至质量不再改变,测得反应前后钠元素的质量分数之比为17:20,则生成二氧化碳和水的质量和为_____。
【答案】3g
【解析】
根据碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳进行分析。
碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳,化学方程式为:![]() ,由化学方程式可以看出,固体减少的质量就是水和二氧化碳的质量,设固体减少的质量为x,钠元素的质量为a那么反应前固体中钠元素的质量分数为:
,由化学方程式可以看出,固体减少的质量就是水和二氧化碳的质量,设固体减少的质量为x,钠元素的质量为a那么反应前固体中钠元素的质量分数为:![]() ,反应前后固体中钠元素的质量分数之比为17:20,反应后固体中钠元素的质量分数为:
,反应前后固体中钠元素的质量分数之比为17:20,反应后固体中钠元素的质量分数为:![]() ,反应前后钠元素质量不变,所以反应后固体质量为17g,生成水和二氧化碳的质量之和为20g-17g=3g。故填:3g。
,反应前后钠元素质量不变,所以反应后固体质量为17g,生成水和二氧化碳的质量之和为20g-17g=3g。故填:3g。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案【题目】某小组在学习“二氧化碳制取的研究”课题时,进行了一系列探究实验。请你一起参与他们的活动,并回答以下问题。探究活动一:能否用排水法收集CO2
(查阅资料)(1)标况下,1体积的水溶解1体积的CO2
(2)一定浓度的稀盐酸和石灰石反应时,CO2气体生成和从水面逸出的速率远大于其溶解和与水反应的速率;
(3)向澄清的石灰水中通入过量的CO2发生了如下反应;CaCO3+H2O+CO2=Ca(HCO3)2
(实验探究)甲、乙两位同学分别用排水法和向上排空气法收集两瓶体积相同的CO2
甲 | 乙 | ||
实验步骤 | (1)甲、乙两位同学各收集一瓶CO2(两个集气瓶体积相同) | 向上排空气法收集并验满(理由:CO2_____,且不与空气的成分发生反应;验满方法:_____) | 排水法收集,无需验满(集满现象:_____) |
(2)向集气瓶中倒入等体积适量的澄清石灰水 | 石灰水先浑浊后变澄清所需时间较长 | 石灰水先浑浊后变澄清所需时间较短 |
(实验结论)可以用排水法收集CO2而且,与向上排空气法相比,排水法在收集CO2时有以下优点_____。
活动小组的同学还发现块状石灰石和适量稀盐酸反应至气泡逸出不明显后,测得其残留液pH=2.对此他们继续进行探究:
探究活动二:反应后溶液pH的变化取适量反应后的溶液。逐滴滴入碳酸钠溶液,并用pH数字探测仪连续监测,得曲线如图(纵坐标为pH,横坐标为时间);
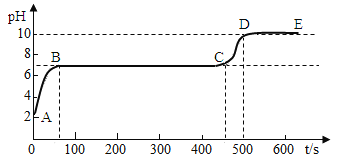
(1)请解释反应后溶液pH=2可能的原因:_____
(2)写出AB段内有关化学方程式:_____。
(3)写出BC“平台”段化学方程式:_____。
(4)CD段上升的原因是:_____。