��Ŀ����
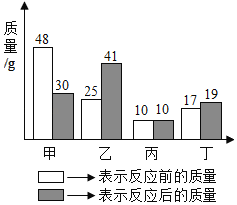
����Ŀ����Ȼ����һ�ֱȽ����Ļ�ʯ��Դ����Ҫ�ɷ��Ǽ��顣ij��ȤС���ͬѧ�ͻ�ѧ�̲��ϵ�ϰ�⣺�����ʵ��֤�������к�����Ԫ�غ�̼Ԫ�ء�չ����̽�����
���������ϣ���1������ˮ�����ƺͼ�ʯ�����ֹ���ҩƷ������ĥ���Ȼ�Ϻ�װ���Թ��У����Ⱥ�����������塣
��2��ͨ������£�������һ����ɫ��ζ������ˮ�����壬�ܶȱȿ���С��
����ȡ̽����
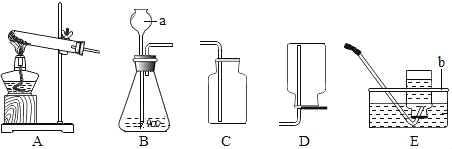
�����ṩ�������ش�
��1��ͼ�б�ʶa������������______��
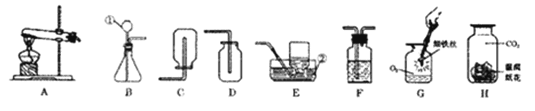
��2����������ʵ������ȡ����ķ���װ��Ϊ______����A��E��ѡ����
��3�������ռ������װ��Ϊ______��
�����̽����
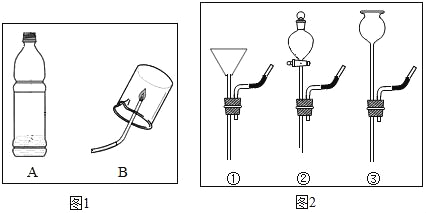
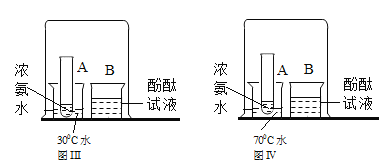
ͬѧ���ռ���һƿ�����ļ������壨ͼ1�е�A���������ͼ��װ��������¸��⣺
��1��Ҫ��A�е�����ͨ��Bװ���У�Ӧѡͼ2�е�______������ţ���עˮװ��
��2��B���Ǹ�����ձ�������ȼ�պ��ձ��ڱ���______���֣�֤��������һ��������Ԫ�أ���B���ձ�Ѹ�����Ų������еμ�______����______��֤��������һ������̼Ԫ�ء�
��3����ʵ���ܷ�֤����������̼��Ԫ����ɵ�̼�⻯����______����ܡ����ܡ���
��Ӧ��̽����
����[CO��NH2��2]��һ�ֳ��õ��ʡ���ͼΪ������Ȼ�������ص���Ҫ���̡�
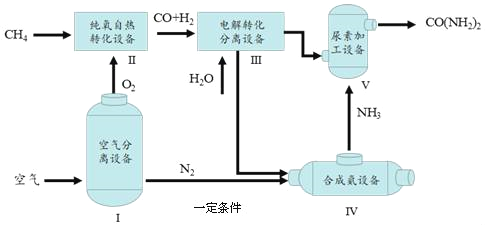
��1���豸���з����ķ�Ӧ�����Ļ�����Ӧ������______��
��2���豸���в��������뿪CO2��H2��������һ�豸ʹ�á���������ͼ���жϽ����豸������______��д��ѧʽ����
��3���豸V�з�����Ӧ��2NH3+CO2�TCO��NH2��2+H2O�����豸���ϳ�NH3������Ϊ17t������������������______t���ء���д��������̣�
���𰸡�����©�� A C �� ˮ�� ����ʯ��ˮ ����ʯ��ˮ����� ���� �û���Ӧ H2 30
��������
��1������ʵ���ҳ������������ƺ�������ָ���������ý��з�����
��2������ʵ������ȡ����ķ�Ӧ���ǹ��壬��Ӧ�����Ǽ��Ƚ��з�����
��3�����ݼ�����һ����ɫ��ζ������ˮ�����壬�ܶȱȿ���С���з�����
��4�����ݢ٢ڢ�װ�õIJ������Լ���ʵ���Ҫ����з�����
��5�������ձ��ڱڳ���ˮ����˵������ȼ����ˮ���ɣ�����ʯ��ˮ���������������̼�Ĵ��ڽ��з�����
��6�����������غ㶨�ɽ��з�����
��7�������豸���з����ķ�Ӧ���������ͼ��鷴Ӧ����һ����̼���������з�����
��8�������豸���в����������CO2��H2�������ʣ���������ͼ�������غ㶨�ɿ����жϽ����豸������H2���з�����
��9�����ݻ�ѧ����ʽ�����е����ݽ��з�����
��1��ͨ������������ָ���������ƺ����ÿ�֪��a�dz���©�����ʴ�Ϊ������©����
��2��ʵ������ȡ����ķ�Ӧ���ǹ��壬��Ӧ�����Ǽ��ȣ����Կ�������ʵ������ȡ����ķ���װ��ΪA���ʴ�Ϊ��A��
��3��������һ����ɫ��ζ������ˮ�����壬�ܶȱȿ���С�����Բ����ռ������װ��ΪC�ʴ�Ϊ��C��
��4����Ҫ�õ�ƽ�ȵ���������Ҫ�ܹ����Ʒ�Ӧ���ٶȣ�ͨ��ˮ�ĵμ���ʵ�֣����ѡ���Һ©������ѡ���ڣ�
��5�����������غ㶨�ɿ�֪���ձ��ڱ��ϵ�ˮ����Ԫ�������ڼ��飬����ʯ��ˮ����ǿ���֤��������̼�Ĵ��ڣ�������̼�е�̼Ԫ�������ڼ��飬�ʴ�Ϊ��ˮ��������ʯ��ˮ������ʯ��ˮ����ǣ�
��6�������������ڵ�ȼ�������·�Ӧ����ˮ�Ͷ�����̼�������к�����Ԫ�أ�������ȷ���������Ƿ�����Ԫ�أ�
��7���豸���з����ķ�Ӧ���������ͼ��鷴Ӧ����һ����̼���������÷�Ӧ�����û���Ӧ���ʴ�Ϊ���û���Ӧ��
��8���豸���в����������CO2��H2�������ʣ���������ͼ�������غ㶨�ɿ����жϽ����豸������H2���ʴ�Ϊ��H2��
��9���⣺�����������ص�����Ϊx
2NH3+CO2��CO��NH2��2+H2O
34 60
17t x
![]() ��
��![]()
x��30t
����������������30t����

����Ŀ������Ǽ��ּ��������Ĺ��ܺ���Ч�ɷ֡����ݱ�����Ϣ���ش��������⡣
���� |
����� |
��ƱҺ |
Ư��ˮ |
���� | ����۹�������ζ | Ưϴ���ʹɫ������ | Ư���������� |
��Ч�ɷ� |
|
|
|
��1��������������Ч�ɷ��У�������������ǣ��ѧʽ��______��
��2������ʯ�ϵ��۹������á�����顱����������______���û�ѧ����ʽ��ʾ����
��3����ʢ����������ƯҺ�����Թ��У��������������̣��۲쵽��������______���䷴Ӧ�Ļ�ѧ����ʽΪ______��
��4��������顱�롰Ư��ˮ�����ܻ��á��������������Ч�ɷ�֮���ܷ�����ѧ��Ӧ�������Ȼ��ơ�ˮ���ж�������![]() ����ѧ����ʽΪ______��
����ѧ����ʽΪ______��
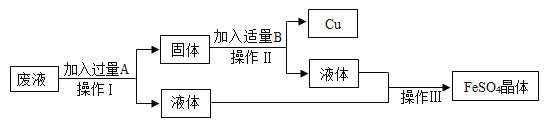
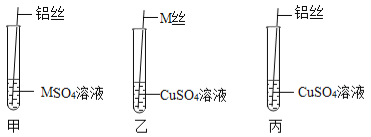
����Ŀ��M�������г����Ľ�����MSO4��Һ����ɫҺ�壬ij��ѧ��ȤС���ͬѧ��̽��M��ͭ�����Ļ��˳�����������һ���������̽�����
��������⡿M��ͭ�����Ľ������˳���������ģ�
����������衿С���IJ�����Al��Cu��M��Сǿ�IJ�����Al��M��Cu����IJ����� ��
�������ʵ��һ��С��ȡM˿��ͭ˿����˿�ͱ��Ϊ������������3֧�Թܣ����������ʵ�飨�Թ��о�ʢ�������ͬ��������������Ҳ��ͬ��ϡ���ᣩ��
ʵ����� | M˿�����Թ����� | ��˿�����Թ����� | ��˿�����Թ����� | ʵ����� |
�տ�ʼ������ | ���������ݲ��� | ������ | ������ | M��Cu�� |
�����Ӻ������ | ���������ݲ��� | ������ | �д������ݲ��� |
|
����������ͬѧ�Ƕ�ͬһʵ��ó����ֲ�ͬ���۵�������������ۣ�������ʵ��տ�ʼʱ�Թ����������ݲ�����ԭ��ԭ���� ��
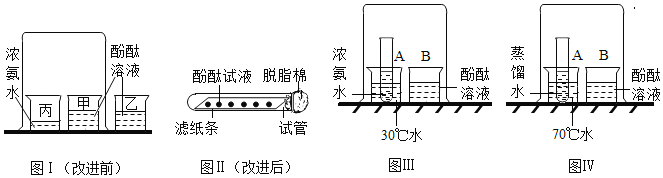
�������ʵ�����Ϊ�˽�һ��̽�����ֽ����Ļ��˳��ͬѧ��ȡ��ϸ��ͬ����ĥ�ɾ���M˿����˿�������Һ���ֽ�������ͼ��ʾ��ʵ�飺
��1���Թ����й۲쵽�������� ��
��2���Թܱ��з�Ӧ�Ļ�ѧ����ʽΪ ��
����������ͬѧ�Ǿ����ۺ���Ϊ��ʵ������Ż���ȥ���Թ� �����Թܱ�ţ��е�ʵ�飬Ҳ���Եó���ȷ�Ľ�����
����������ۡ�ͨ������ʵ�飬ͬѧ�ǵó������ֽ����Ļ��˳����
�������뷴˼��ʵ�������ͬѧ�Ƕ�ʵ����̽��������·�˼��
��1��Ӱ��������ᷴӦ���ʿ��������أ��������Ӧ�Ľ�������������⣬���� ����дһ�֣�
��2��̽���������˳��ʱ����������ʵ�����Ѿ��õ������ַ����⣬�����Ը��� �����жϣ���дһ�֣�