题目内容
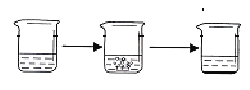
【题目】石灰石是我市主要矿产之一,小江同学为了寻找含碳酸钙质量分数超过85%的石灰石,对一样品进行了如下定量实验。
实验步骤 | ①将适量盐酸加入烧杯中并称重 | ②称取少量石灰石样品加入烧杯中,使之与过量稀盐酸反应 | ③待反应完全后,称重 | |
实验图示 |
| |||
实验数据 | 烧杯和盐酸的质量为100.0g | 石灰石样品的质量为12.0g | 烧杯和其中混合物的质量为107.6g | |
试通过分析计算(结果保留一位小数):
(1)该实验中生成的二氧化碳的质量是___________。
(2)试通过计算推断该石灰石样品的纯度是否符合要求?(样品中的杂质不与盐酸反应)
(3)若碳酸钙质量分数超过85%的石灰石其含钙的质量分数为a% ,则a的取值范围是 (石灰石样品中的杂质不含钙)。
【答案】(1)4.4g;(2)不符;(3)34<a<40
【解析】
(1)该实验中生成的二氧化碳的质量是100.0g+12.0g-107.6g=4.4g;
(2)CaCO3 →CO2,
![]() =
=![]() ,x=10g. 该石灰石样品的纯度是
,x=10g. 该石灰石样品的纯度是![]() ×100%=83.33%<85%.
×100%=83.33%<85%.
不符合要求。
(3)解∶设样品质量为xg
![]() ×100×=34%, 3)若碳酸钙质量分数超过85%的石灰石其含钙的质量分数为a% ,则a的取值范围是 34<a<40.
×100×=34%, 3)若碳酸钙质量分数超过85%的石灰石其含钙的质量分数为a% ,则a的取值范围是 34<a<40.
答∶(1)该实验中生成的二氧化碳的质量是4.4g;2)通过计算推断该石灰石样品的纯度是不符合要求。(3)若碳酸钙质量分数超过85%的石灰石其含钙的质量分数为a% ,则a的取值范围是34<a<40。
点睛∶本题主要考查质量守恒定律的应用以及有关质量分数的计算。

【题目】合理利用资源和保护环境是我们关注的问题。请回答:
(1)化石燃料是一类重要能源,它包括煤、石油和__________。
(2)煤作为燃料给我么们带来了益处,但对环境也造成了不良影响。
①下列关于酸雨的叙述正确的是__________(填序号)
A. 腐蚀大理石雕像 B. 是由二氧化碳和二氧化硫引起的
C. 酸化土壤 D. 对海洋生物没有影响
②使燃料充分燃烧,通常除了考虑燃烧时要有足够的空气,还要考虑___________;
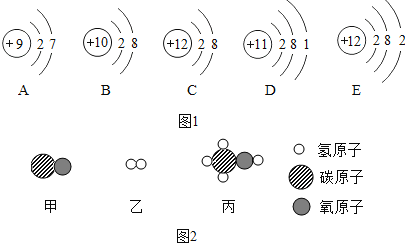
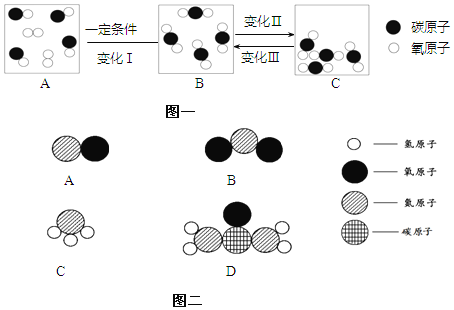
(3)为减少污染,城市公共交通正大力推广使用压缩天然气或液化石油气为动力。某种清洁燃料的主要成份是A,一定质量的A物质在B物质中充分燃烧,如下表所示)。
物 质 | A | B | C | D |
|
分子示意图 | ? |
|
|
| |
反应前质量/g | 44 | ? | 0 | 0 | |
反应后质量/g | 0 | 0 | 132 | 72 |
①在上述反应中提供氧、具有氧化性的物质为______________。(写化学式)
②A物质中各元素的质量比为________________。