题目内容
【题目】实验室以某石灰石(含少量Fe2O3)为原料制备高纯CaCO3的步骤如下:
溶解 向石灰石样品中加入适量盐酸,至反应完全。
除铁 加入氨水调节pH,然后加入适量Ca(OH)2,充分反应后过滤。
沉淀 向滤液中补充氨水,通入CO2,反应一段时间。
分离 过滤、洗涤、干燥得高纯CaCO3
(1)溶解时,CaCO3与盐酸反应的化学方程式为_______。判断样品已完全反应的实验现象是_______。
(2)除铁时,选用Ca(OH)2而不选用NaOH,其主要原因是Ca(OH)2价格低且来源广、__________、__________;过滤所得滤渣主要成分为___________。
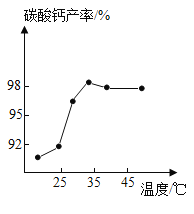
(3)沉淀时,其他条件相同,反应温度对CaCO3产率的影响如图。高于35℃时,CaCO3产率下降的主要原因是__________。
(已知:产率=![]() ×100%)
×100%)
(4)分离时,若向过滤所得滤液中加入________(填化学式)并加热,则可回收NH3。
(5)该实验可以循环利用的物质有H2O和________。
(6)石灰厂煅烧石灰石生产CaO,若要得到28tCaO,则至少需要含CaCO390%的石灰石多少吨________?(写出计算过程,保留一位小数)
【答案】![]() 向固体中加入稀盐酸,固体不再溶解、无气体生成 避免引入新的杂质 提高产量 Fe(OH)3 温度升高,二氧化碳溶解能力下降;温度升高,氨水中氨气逸出 Ca(OH)2 CO2 55.6t(详见解析)
向固体中加入稀盐酸,固体不再溶解、无气体生成 避免引入新的杂质 提高产量 Fe(OH)3 温度升高,二氧化碳溶解能力下降;温度升高,氨水中氨气逸出 Ca(OH)2 CO2 55.6t(详见解析)
【解析】
(1)溶解时,CaCO3与盐酸反应的化学方程式为 CaCO3+2HCl═CaCl2+H2O+CO2↑;判断样品已完全反应的实验现象是加入盐酸,无气体生成;
(2)除铁时,选用Ca(OH)2而不选用NaOH,氢氧化钙和氢氧化钠相比,价格低,来源广,由于最终要制取碳酸钙,所以不引入新的杂质;所以选用Ca(OH)2而不选用NaOH其主要原因是Ca(OH)2价格低且来源广、增加产量、不引入新的杂质;根据滤液最终转化为碳酸钙,可知过滤过程中除去的是铁元素对应的化合物,应该是氢氧化铁,所以过滤所得滤渣的主要成分为氢氧化铁;
(3)沉淀时,其他条件相同,反应温度对CaCO3产率的影响 图。高于35℃时,CaCO3产率下降的主要原因是氨水浓度降低、二氧化碳溶解能力降低;
(4)分离时,所得滤液中含有氯化铵,由于铵根离子遇到可溶性碱生成氨气,所以可以选择加入碱,由于整个流程制备碳酸钙,所以加入氢氧化钙以便后期综合回收利用,所以向过滤所得滤液中加入 Ca(OH)2并加热,则可回收NH3;
(5)开始二氧化碳是生成物,后来是反应物,所以该实验中可以循环利用的物质有除H2O外,还有 CO2;
(6)设若要得到28tCaO,则至少需要含CaCO390%的石灰石的质量为x,
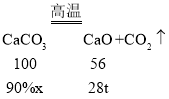
![]()
x≈55.6t。

【题目】某研究小组发现,维C泡腾片(保健药品,主要成分见图1),溶于水后有许多气泡产生(如图2).该小组同学进行如下探究。
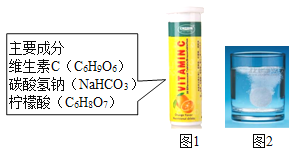
[提出问题]该气体的成分是什么?
该气体不可能含有SO2,因为________。
[提出猜想]Ⅰ.CO2 Ⅱ.__________。 Ⅲ.CO2和O2
[进行实验]
步骤 | 实验操作 | 实验现象 | 结论及化学方程式 |
(1) | 将气体通入________。 | _________。 | 该气体含有CO2,方程式是________。 |
(2) | 将带火星的木条伸入该气体中。 | 带火星的木条没有复燃。 | 该气体不是纯氧气。 |
[得出结论]该气体含有CO2_______(填“能”或“不能”)确定该气体中是否含氧气,理由是_________。
[讨论交流]维C泡腾片溶液是否呈酸性。向维C泡腾片溶液中滴加________试剂,溶液_______,说明该溶液显酸性。