题目内容
(6分)2013年12月2日,我国“嫦娥三号”探测器由长征三号运载火箭发射,首次实现月球软着陆和月面巡视勘察。“玉兔”月球车底盘和车轮由铝合金材料制成。看见玉兔车金灿灿的车身后,小聪同学想到家里新换的水龙头,从说明书上了解到该水龙头是铜质镀铬。好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,请你一同参加。
(1)【知识回放】
金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Ag Pt Au。请你在横线上填写对应金属的元素符号。
(2)【作出猜想】
猜想1.Cr>Fe>Cu; 猜想2.Fe>Cu >Cr; 猜想3.你的猜想是 ____。
【查阅资料】
① 铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
② 铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
(3)【设计与实验】
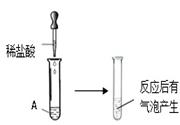
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸。
| 实验 | 试管1 | 试管2 | 试管3 |
| 实验 操作 |  |  |  |
| 实验 现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变成为蓝色 | ______ |
小聪得到的结论是:猜想 正确。
(5)【知识运用】
将铬片投入FeSO4溶液中,反应 (填“能”或 “不能”)进行。若能进行,请你写出反应的化学方程式 ________________。
(1) Hg (2) Fe>Cr>Cu (3) 铜表面无气泡,溶液不变色
(4) 1 (5) 能 Cr+FeSO4=CrSO4+Fe
解析试题分析:(1)常见金属活动性顺序为K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au,故所缺金属为Hg;(2)三种金属的活动性顺序可能存在三种情况:猜想1为Cr>Fe>Cu;猜想2为Fe>Cu>Cr,故猜想3答案:Fe>Cr>Cu;(3)因为铜的活动性顺序位于氢的后面,因此不能和酸反应,表现为无现象;(4)试管1中实验现象铁片表面产生气泡较慢,溶液变为浅绿色,可知金属铁在金属活动顺序中排在氢前,根据铬片表面产生气泡较快,溶液变为蓝色,从而得出铬也排在氢前且铬比铁活泼,因为铜不能和稀硫酸反应生成氢气,可知铜排在氢的后面,故猜想1.Cr>Fe>Cu正确;(5)因为“铬片表面产生气泡较快溶液变为蓝色”,可知金属铬比铁活泼强,故铬能和硫酸亚铁反应生成硫酸铬和铁,则反应的化学方程式为:Cr+FeSO4=Fe+CrSO4。
考点:金属活动顺序的应用于探究

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(8分)常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物。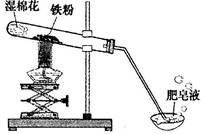
(1)试管尾部放一团湿棉花的目的是_______________。
(2)探究生成的气体是什么?
用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。 说明生成的气体是______________。
(3)探究试管中剩余固体成分是什么?
【查阅资料】
| 常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 能否被磁铁吸引 | 否 | 否 | 能 |
【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;猜想二:剩余固体是_____________。
【实验探究】
| 实验操作 | 实验现象及结论 |
| | |
【反思与交流】该黑色固体不可能是Fe2O3,理由是_______________________________。
(7分)同学们在学习Ca(OH)2的化学性质时,对Ca(OH)2溶液和Na2CO3溶液反应后溶液中溶质的成分进行探究。请你一同探究并回答下列问题:
【提出问题】:滤液中的溶质是什么物质?溶液呈中性。
【查阅资料】:①Ca(NO3)2溶液呈中性。 ②Ca(NO3)2 +Na2CO3= CaCO3↓+2NaNO3
【猜想假设】:甲同学认为:只含有NaOH; 乙同学认为:只含有NaOH Ca(OH)2;
丙同学认为:含有NaOH Ca(OH)2 Na2CO3; 你认为可能含有 。
【分析讨论】:丁同学认为 同学的猜想肯定是不合理的,理由是 。
【实验设计】:请你设计一个简单的实验来验证你的猜想是正确的。
| 实验步骤 | 实验现象 | 实验结论 |
| 取滤液于试管中 | | 猜想正确 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取滤液于试管中滴加少量的稀盐酸 | 无明显现象 | 猜想正确 |
【反思拓展】:在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑
。
(8分)有位化学教师取用生石灰时,发现装满生石灰的塑料试剂瓶已经膨胀破裂,于是请同学们进行了如下探究:
(1)取一定量样品于烧杯中,加入适量的水充分搅拌,用手触摸烧杯外壁,无明显现象。由此说明该样品中不含有 ;
(2)对该样品成分进行了如下猜想:
猜想① Ca(OH)2 猜想② Ca(OH)2和 CaCO3的混合物 猜想③ CaCO3
以下是某同学对猜想②进行的探究,请你补充完成实验报告
| 实验操作 | 预期现象与结论 |
| | , 说明固体中含有Ca(OH)2。 |
| | , 说明固体中含有CaCO3。 |
(7分)我省赣州稀土资源丰富,稀土开采工序中使用的草酸、硫酸铵等产生的大量废水严重污染农业用水和生活用水。某研究性学习小组对此展开了研究。
[查阅资料]
(一)草酸的化学式为H2C2O4,草酸是一种无色透明的晶体,对人体有害,具有酸的通性:如能与碳酸盐反应产生二氧化碳,能与金属反应等。
例如:H2C2O4+Na2CO3==Na2C2O4+CO2↑+H2O
(二)CO遇到浸有磷钼酸溶液的氯化钯黄色试纸立即变蓝,而CO2遇试纸不变色。
回答下列问题:
(1)写出金属铁与草酸反应的化学方程式
(2)硫酸铵在农业上可作化肥使用,在施肥时不能将它与 混合使用。
[设计方案]草酸加热能分解生成水和气体,研究性学习小组的同学对受热分解生成的气体作如图所示的探究:
[实验探究]该研究性学习小组同学通过观察实验中的现象,验证猜想。
[现象与结论]请你帮助他们完成报告:
| 步骤 | 现象 | 结论 |
| 点燃酒精灯加热,观察装置C和D中的现象 | 装置C中 装置D中 | 产生的气体有CO 产生的气体有CO2 |
(2)根据结论,从环保的角度考虑,装置中存在不足之处,正确的处理方法是
(11分)实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样。已知它是无色液体,是初中化学常用的试剂。小强和小华同学很感兴趣,决定对其成分进行探究:
【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是 。
A.酸 B.碱 C.盐
【查阅资料】
Ⅰ.初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
Ⅱ. Na2CO3和NaHCO3溶液都呈碱性。
Ⅲ.测定室温(20℃)时,四种物质的溶解度的数据如下:
| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度/g | 36 | 109 | 215 | 9.6 |
这瓶试剂不可能是 。
【作出猜想】①可能是 溶液;②可能是Na2CO3溶液;③可能是NaCl。
【设计并实验】
(1)小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,这瓶试剂不可能是。
(2)小强为了检验该溶液是NaOH溶液还是Na2CO3溶液,他又进行了如下实验:
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中, 滴加氢氧化钙溶液 | | 猜想②正确 相关的化学方程式 |
小华同学用上述溶液对实验室制取CO2气体的废液进行后续探究,他向100克的废液中逐滴加入上述Na2CO3溶液。实验过程中加入Na2CO3溶液质量与产生沉淀或气体的质量关系如图1所示;加入Na2CO3溶液的质量与溶液的PH变化关系如图2所示

(3)小华同学所取废液中的溶质含
(4)图1中b→c段反应过程中溶液的PH变化情况可用图2中 段表示
(5)图1中b和x的值分别为 克和 克