题目内容
化学家通过化学反应开发出了很多物质,推进了人类社会物质文明的进步。下列化学反应中,相关反应与反应类型标注均相符的是
A.电解法冶炼铝: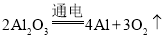 化合反应
化合反应
B.制备氢氧化钙: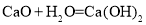 分解反应
分解反应
C.生产水煤气: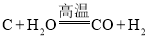 置换反应
置换反应
D.工业制烧碱: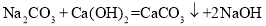 氧化反应
氧化反应
除去下列各物质中混有的少量杂质,所用试剂及操作方法如下表,能完成提纯的是
序号 | 物质 | 杂质 | 所用试剂和操作方法 |
A | H2 | HCl | 通过足量的AgNO3溶液,干燥 |
B | NaNO3溶液 | Na2SO4 | 加入过量的Ba(NO3)2溶液,过滤 |
C | NaCl固体 | Na2CO3 | 加入足量水溶解,过滤 |
D | 铁粉 | Fe2O3 | 加入适量的稀盐酸,过滤 |
A.A B.B C.C D.D
氯酸钾有多种用途,常作氧化剂、火箭推进剂等,它易溶于水,在加热时可缓慢释放氧气,但在氧化铜等催化作用下加热会快速放出氧气。小华利用氯酸钾制取氧气来验证氧化铜的催化作用,并探究反应后剩余固体的成分。
(查阅资料)①氯化钾、氧化铜加热不分解;
②硫酸铜易溶于水,溶解度随温度的升高而增大;
③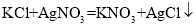
I.催化剂的制备

(1)步骤1的目的是除去不溶性杂质,步骤1所用到的玻璃仪器有_____。
(2)步骤2的目的是得到CuSO4.5H2O晶体,实验操作是_____、降温结晶、过滤、洗涤、干燥。
Ⅱ.加热氯酸钾制取氧气并探究剩余固体的成分
小华设计了以下两组实验,在相同条件下加热,并记录产生VL氧气所需要的时间,实验发现t1>t2,说明氧化铜可以加快氯酸钾的分解,相关数据如下表。
实验编号 | 反应前氯酸钾的质量 | 加入氧化铜的质量 | 生成VL 氧气所用的时间 | 反应后剩余固体的质量 |
ⅰ | 24.5g | 0 | t1 | m |
ⅱ | 24.5g | 2.0g | t2 | 21.7g |
(1)实验ⅰ中反应后剩余固体的质量m=_____。
(2)探究实验ⅱ反应后剩余固体的成分和氧化铜的催化作用,部分数据如下表。
实验步骤 | 现象或结论 |
①将反应后剩余固体继续加热,直至冷却后连续两次称量固体的质量保持不变。 | 若有气体生成,则说明含有氯酸钾,该反应的化学方程式为_____。 |
②将①加热后剩余固体在足量水中充分溶解,过滤、洗涤、干燥、称量 | 若滤渣的质量为_____,可进一步说明氧化铜对氯酸钾分解有催化作用。 |
③收集、合并②的滤液和洗涤液,加入过量硝酸银溶液,充分反应后过滤、洗涤、干燥、称量 | 理论上可得到沉淀的质量为_____。 |