题目内容
【题目】氧烛是一种用于缺氧环境中自救的化学氧源,广泛用于航空、航海等领域,其主要成分为NaClO3,还含有适量的催化剂、成型剂等。氧烛通过撞击火帽引发反应后,能持续放出高纯氧气,主要反应原理为![]() 。一根氧烛大约可以供100个人呼吸1小时。下列说法不正确的是
。一根氧烛大约可以供100个人呼吸1小时。下列说法不正确的是
A.氧烛是一种纯净物
B.氧烛制取氧气的反应为分解反应
C.NaClO3可用于医疗
D.运输氧烛时,应避免其受到撞击
【答案】A
【解析】
A、氧烛的主要成分为NaClO3,还含有适量的催化剂、成型剂等,属于混合物,故选项说法错误。
B、氧烛制取氧气的反应为2NaClO3═2NaCl+3O2↑,该反应符合“一变多”的特征,属于分解反应,故选项说法正确。
C、氯酸钠撞击分解为氯化钠和氧气,所以可用于医疗,故选项说法正确。
D、氧烛通过撞击火帽引发反应后,能持续放出高纯氧气,在运输氧烛时,应避免其受到撞击,故选项说法正确。
故选:A。

【题目】(1)热水瓶用久后,瓶胆内壁常附着一层水垢,老师说其成分主要是碳酸钙、碳酸氢钙、氢氧化镁等。小组同学认为可使用稀盐酸除去,请写出发生中和反应的化学方程式________________________。
日常生活中,每位同学都会接触到硬水。某校化学兴趣小组的同学在老师的带领下对硬水进行了一些探究和拓展实验。
(查阅资料)水的硬度是由水中溶解的可溶性钙和镁化合物引起的,硬水中溶解的钙和镁化合物可分为两类:钙、镁的碳酸氢盐:钙、镁的硫酸盐或氯化物,一般所说的水的硬度是由上述两类化合物引起的。
(2)小组同学对硬水中为什么含有碳酸氢钙非常感兴趣,于是再次学习九年级化学下册课本中的资料卡片:石笋和钟乳石的形成。知道了当石灰岩遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:CaCO3+CO2+H2O=Ca(HCO3)2小组同学思考:若向碳酸钠溶液中通入一定量的二氧化碳,是否也能生成碳酸氢钠?
于是他们对此开始实验探究(不考虑二氧化碳和碳酸作为溶质的情况)。
(提出问题)所得溶液中溶质是什么?
(提出猜想)
猜想一:溶质为Na2CO3;
猜想二:溶质为 NaHCO3;
猜想三:溶质为___________。
(设计实验)
实验步骤 | 实验现象 | 实验结论 |
a.__________________________。 | 有白色沉淀生成 | 猜想二_________________ (填“成立”或“不成立”) |
b.取实验步骤a中上层清液,滴 加适量稀盐酸 | 有气泡冒出 | 猜想一不成立 |
写出实验步骤b中发生反应的化学方程式_____________________。
通过实验,小组同学得出了正确结论。
(拓展)氢氧化钠溶液中通入过量二氧化碳气体,反应的化学方程式为__________。
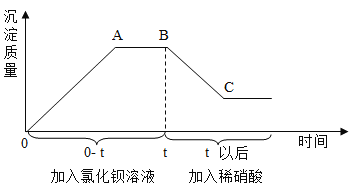
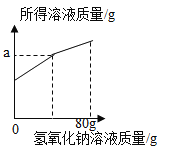
【题目】实验技能训练中,小亮同学向氧化铜和稀硫酸充分反应后的废液中加入一定量的氢氧化钠溶液,发现无明显现象。小亮同学在老师的指导下对反应后的废液进行了实验:他分别取50g废液,并向其中逐渐加入等浓度的氢氧化钠溶液,三组实验的数据与其中一组的图象如下:
实验组数 | 第一组 | 第二组 | 第三组 |
加入氢氧化钠溶液质量/g | 50 | 100 | 80 |
产生沉淀的质量/g | 0.98 | 2.94 | 2.94 |
请根据以上信息回答下列问题:所得
(1)废液中的溶质有_____(填化学式)。
(2)计算废液中硫酸铜的溶质质量分数。_____(写出计算过程)
(3)若三组数据中,只有某一组加入的氢氧化钠溶液与废液恰好完全反应,则该实验为第_____组,下图中a的数值为_____。
【题目】探究物质燃烧。巴黎圣母院大火造成的重大损失再次提醒人们,合理的控制燃烧非常重要,小明利用下列装置对物质燃烧进行探究,探究过程和观察记录如下:
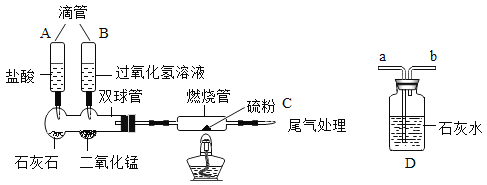
实验①:根据装置图组装仪器,不点燃酒精灯,观察到硫不燃烧。
实验②:点燃酒精灯,观察到硫燃烧,发出微弱的淡蓝色的火焰。
实验③:更换燃烧管(装有等量硫粉),挤压滴管A,在尾气处理接口接上D装置,观察到溶液变浑浊后,点燃酒精灯,硫粉不燃烧。
实验④:更换燃烧管(装有等量硫粉),拆除D装置,挤压滴管B点燃酒精灯,硫粉燃烧发出明亮的蓝紫色火焰
(1)上述实验中的对照实验(填实验编号)和获得的相应结论。
第1组对照实验:_________,结论:__________。
第2组对照实验:_________,结论:__________。
第3组对照实验:_________,结论:__________。
(2)实验③中需待D中溶液变浑浊后再点燃酒精灯,其原因是________________。
(3)写出上述实验中发生化学反应的方程式___________________(不包括处理尾气的反应)
(4)有一种吹不灭的蜡烛,点燃后任你怎么吹也吹不灭。
(查阅资料)该蜡烛芯上包裹一层打火石的粉末。打火石是由某种金属掺入少量稀土元素制成的合金,它的着火点只有150℃。当蜡烛燃烧时,金属并不燃烧;但当蜡触吹灭后,未冷却的金属发生燃烧,从而使蜡触复燃。蜡烛燃烧时金属不燃烧的原因是__________;试再举一例运用此原理灭火的生活事例_______________。
(实验探究)吹不灭的蜡烛芯内的金属可能是镁、铁或铜中的一种,为确定该金属的成分,请你自选试剂继续探究并完成下列有关问题:(注:不考虑打火石中稀土元素对探究金属性质的影响)
操作步骤 | 现象 | 结论 |
切开蜡烛,取出打火机,用砂纸打磨 | 打火石是银白色 | __________ |
取少量打磨后的打火石于试管中,__________ | ____________ | 该金属是镁 |
在上述探究触芯内金属成分的过程中,运用的科学方法有_______________。