题目内容
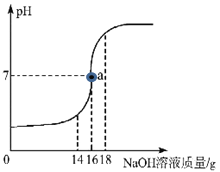
【题目】将10%的NaOH溶液逐滴加入到20克稀盐酸中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化如图所示:
请计算:
(1)a点溶液中大量存在的离子有 。(写符号)
(2)当恰好完全反应时,消耗NaOH的质量为 克。
(3)计算稀盐酸中溶质的质量分数。
【答案】(1)Na+ Cl-;(2)1.6;(3)7.3%
【解析】(1)氢氧化钠和盐酸恰好完全反应,a点溶液中大量存在的离子有)Na+ Cl-。(2)当恰好完全反应时,消耗NaOH的质量为16g×10%=1.6克。
﹙3)解∶设稀盐酸中溶质的质量分数为x
NaOH+HCl=NaCl+H2O
40 36.5
1.6g 20g×x
![]() =
=![]() ,x=7.3%.
,x=7.3%.
答∶稀盐酸中溶质的质量分数为7.3%.
点睛∶本题主要考查质量守恒定律的应用以及根据化学方程式进行计算。

【题目】某实验小组的同学用氢氧化钙溶液和稀盐酸做中和反应实验时,向烧杯中的氢氧化钙溶液加入一定量稀盐酸后,发现忘记了滴加指示剂,此时,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
Ⅰ.写出该中和反应的化学方程式:___________________。
Ⅱ.探究烧杯内溶液中溶质的成分。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】甲、乙、丙三位同学分别作出了猜想,请你补充丁同学的猜想。
同学甲:可能是CaCl2和Ca(OH)2; 同学乙:可能只有CaCl2;
同学丙:可能是CaCl2、HCl和Ca(OH)2 同学丁:可能是_________。
你认为该小组同学的猜想中不需做实验就可以否定的是___________。
【查阅资料】氯化钙溶液呈中性。
【进行实验】
实验步骤 | 实验操作 | 实验现象 | 实验结论 |
实验1 | 取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡 | _____ | 同学甲猜想不正确 |
实验2 | 另取少量烧杯内溶液于试管中,逐滴加入碳酸钠溶液至过量 | 先有______,后有 ______。 | 同学丁猜想正确 |
【反思与拓展】
(1)在分析化学反应后所得物质成分时,除考虑生成物外还需考虑____________。
(2)根据所学化学知识,验证烧杯内溶液中的溶质是否含有Ca(OH)2,除以上方案外,下列哪些物质单独使用也能完成该实验?___________(填序号)
a.pH试纸 b.铜 c.二氧化碳 d.氧化铜
Ⅲ.取10g烧杯中的溶液,向其中逐滴滴入溶质质量分数为5.3%的碳酸钠溶液,同时充分搅拌。测得溶液pH与加入的碳酸钠溶液的质量关系如图所示。

(1)由图可知,当碳酸钠溶液质量加到_____________g时,溶液中盐酸恰好反应完;
(2)原烧杯溶液中氯化钙的质量分数______________。(写出计算过程)