题目内容
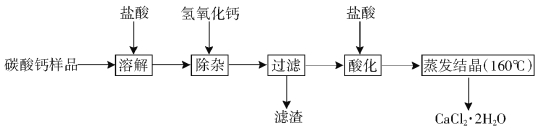
【题目】(9分)医用二水合氯化钙可用于补钙、抗过敏和消炎等,以某碳酸钙样品(其中含少量Al3+、Fe3+等杂质)生产医用二水合氯化钙的工艺流程为: (已知二水合氯化钙在温度超过160°C时分解为氯化钙和水)
已知:查阅资料得知氢氧化物沉淀及溶解时的pH为:
氢氧化物 | Fe(OH)3 | Al(OH)3 | |
开始沉淀时的pH | 2.3 | 4.0 | 开始溶解:7.8 |
完全沉淀时的pH | 3.7 | 5.2 | 完全溶解:10.8 |
(1)在实验室进行溶解时玻璃棒的作用是 ,过滤时用到的玻璃仪器有烧杯、玻璃棒、 。
(2)除杂操作是加入稍过量的氢氧化钙,调节溶液的pH使Al3+、Fe3+全部转化为沉淀,此时应该控制溶液的的pH(X)范围是 ;滤渣A的主要成分的化学式为 。
(3)酸化时加盐酸的主要目的为了 。
(4)蒸发结晶时,必须控制温度低于160℃的原因是 。
(5)若所用碳酸钙样品12.5Kg,最后所得的产物中含氯化钙11.1Kg,则样品中碳酸钙的质量分数最大为多少 ?(写出计算过程,3分)
【答案】(1)加快溶解(速度),漏斗
(2)5.2<X<7.8(或5.2-7.8); Fe(OH)3 、Al(OH)3(少一种不给分)
(3)除去过量的氢氧化钙[(Ca(OH)2 或OH-];
(4)防止二水合氯化钙分解(或防止产物分解)
(5)80%
【解析】
试题分析:(1)溶解时玻璃棒的作用是加快固体物质的溶解速度;过滤时用到的玻璃仪器有烧杯、玻璃棒和漏斗。
(2)根据表格中的数据可知:Fe(OH)3完全沉淀时的pH为3.7;Al(OH)3完全沉淀时的pH为5.2;但当PH 为7.8时 Al(OH)3开始溶解。所以要使Al3+、Fe3+全部转化为沉淀,需要将溶液的的pH控制在5.2-7.8。滤渣A的主要成分为Fe(OH)3 、Al(OH)3
(3)因除杂时为将两种离子全部沉淀,需要加入过量的氢氧化钙,所以酸化时加盐酸的主要目的为了除去过量的氢氧化钙[(Ca(OH)2 或OH-]。
(4)根据题意可知:二水合氯化钙在温度超过160°C时分解为氯化钙和水。为防止二水合氯化钙分解(或防止产物分解)所以蒸发结晶时,必须控制温度低于160℃。
(5)已知量为氯化钙11.1Kg;未知量为样品中碳酸钙的质量分数。解题思路:可根据氯化钙和碳酸钙在反应中的质量关系求出碳酸钙的质量,再进一步求出碳酸钙的质量分数。具体过程如下:
解:设CaCO3最大质量为x
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 111
x 11.1kg
100:111=x:11.1kg
x=10kg
![]() ×100%=80%
×100%=80%
答:样品中碳酸钙的质量分数最大为80%

【题目】将一定量的丙醇(C3 H8O)和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:
物质 | 丙醇 | 氧气 | 水 | 二氧化碳 | X |
反应前质量/g | 6.0 | 12.8 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 7.2 | 8.8 | a |
下列判断正确的是 ( )
A.表中a的值为2.8 B.X一定是该反应的催化剂
C.X可能含有氢元素 D.X中含有碳元素和氧元素