题目内容
(9分)从海水中可以提取镁,其中的一个步骤是将卤水(含Mgcl2、NaCl、KCl的混合液)转化为氯化镁晶体。实验室中模拟该转化的过程如下,回答有关问题a
(1)制备氢氧化镁:向卤水中加入适量生石灰(CaO),充分反应后过滤。
①该过程中发生了多个反应,其中会大量放热的反应是(填化学方程式)_________________
②过滤操作需用到的玻璃仪器除烧杯外,还有__________________________。
(2)制各氯化镁溶液:用盐酸溶解Mg(OH)2。为了便于后续操作.盐酸不宜过量
①反应的化学方程式是_____________________________________。
②通过计算,可准确知道所需盐酸的量。理论上溶解5.8gMg(OH)2需要36. 5%HCl溶液
③由于准确称量Mg(OH)2的步骤繁琐,实验中并不常用,而是通过一定操作方法来达到
到控制盐酸用量的目的。操作是:将Mg(OH)2加入烧杯中,___________________________
直到Mg(OH)2完全溶解为止。
(3)制各氯化镁晶体:蒸发浓缩MgCl2溶液,冷却结晶
(1)制备氢氧化镁:向卤水中加入适量生石灰(CaO),充分反应后过滤。
①该过程中发生了多个反应,其中会大量放热的反应是(填化学方程式)_________________
②过滤操作需用到的玻璃仪器除烧杯外,还有__________________________。
(2)制各氯化镁溶液:用盐酸溶解Mg(OH)2。为了便于后续操作.盐酸不宜过量
①反应的化学方程式是_____________________________________。
②通过计算,可准确知道所需盐酸的量。理论上溶解5.8gMg(OH)2需要36. 5%HCl溶液
③由于准确称量Mg(OH)2的步骤繁琐,实验中并不常用,而是通过一定操作方法来达到
到控制盐酸用量的目的。操作是:将Mg(OH)2加入烧杯中,___________________________
直到Mg(OH)2完全溶解为止。
(3)制各氯化镁晶体:蒸发浓缩MgCl2溶液,冷却结晶
⑴①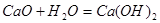 ②漏斗、玻璃棒
②漏斗、玻璃棒
⑵①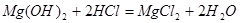
②20 ③用胶头滴管逐滴加入稀盐酸溶液
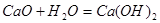 ②漏斗、玻璃棒
②漏斗、玻璃棒
⑵①
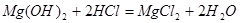
②20 ③用胶头滴管逐滴加入稀盐酸溶液
(1)根据题给信息可知,在制备氢氧化镁的过程中,能放出大量热量的反应应该是生石灰与水的反应;过滤操作用到的玻璃器皿除烧杯外,还需要用到漏斗和玻璃棒。(2)盐酸与氢氧化镁发生的是中和反应,二者反应生成了氯化镁和水,据此书写该反应的化学方程式;依据化学方程式和氢氧化镁的质量可计算出所需纯HCl的质量,进而计算出盐酸的质量。为了防止盐酸过量,盐酸与氢氧化镁的反应中,应该是边滴加稀盐酸边搅拌,使二者充分反应,当氢氧化镁完全溶解为止。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目