题目内容
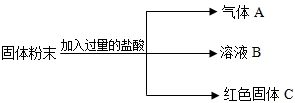
有一包固体粉末,可能是CaCO3、Na2SO4、CuSO4、Na2CO3中的一种或多种,某实验小组对其组成成分进行了以下探究活动。
【思考与交流】(1)上述物质中,不溶于水的是______①_______(填化学式,下同)。
(2)能溶于水,其水溶液呈蓝色的是______②_______。
【资料查阅】Na2CO3溶液与CuSO4溶液混合能产生蓝色沉淀。
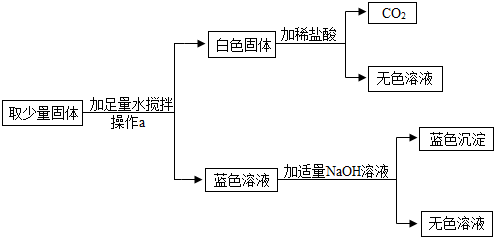
【活动与探究】去一定量上述固体粉末,加足量水溶解。在溶解过程中一定要用到的玻璃仪器有______③_______和玻璃棒,其中玻璃棒的作用是______④_______。
【现象与结论】经上述操作,得到蓝色澄清溶液,则原固体粉末中一定没有____⑤_____和____⑥_____(填化学式)。
【探索与拓展】为进一步确定原固体粉末的组成,该实验小组同学先用托盘天平称取46.2g该粉末,溶于水配成174.6g溶液,再往其中加入溶质质量分数为8%的NaOH溶液,发生如下反应:CuSO4+2NaOH = Na2SO4+Cu(OH)2↓,产生沉淀的质量与所加NaOH溶液质量的关系如图所示。据图回答:(结果保留小数点后一位)
(3)计算产生最大沉淀量时所加NaOH溶液的质量。
(4)通过计算确定46.2g固体粉末的组成。(回答出物质名称和其质量)
(5)计算A点所示溶液中溶质的质量分数。
(1)①CaCO3
(2)②CuSO4 ③烧杯 ④搅拌(加速固体的溶解)
⑤CaCO3 ⑥Na2CO3
(3)解:设生成最大沉淀量时所加NaOH的质量为x,46.2g粉末中含有CuSO4的质量为y生成Na2SO4的质量为z
CuSO4+2NaOH = Na2SO4+Cu(OH)2↓
160 80 142 98
y x z 19.6g

x=16.0g···························1分
那么NaOH溶液的质量=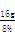 =200.0g··············1分
=200.0g··············1分
y=32.0g···························1分
z=28.4g···························1分
(4)Na2SO4的质量=46.2g-32g=14.2g···············1分
则46.2g固体粉末由14.2g Na2SO4和32.0g CuSO4组成。
(5)Na2SO4的质量分数= 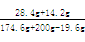 ×100%
×100%
=12.0%··················1分
答:略。
解析:略

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案