题目内容
小海、小林、小明三同学一起测定双氧水溶液中过氧化氢的质量.查阅资料:
常温下氧气密度为1.42g,L;
碱石灰干燥剂是氧化钙和固体氢氧化钠的混合物,极易吸收水蒸汽和二氧化碳.
设计原理:将一定质量的双氧水样品与二氧化锰混合,测定反应产生的氧气的质量,计算出其中过氧化氢的质量.
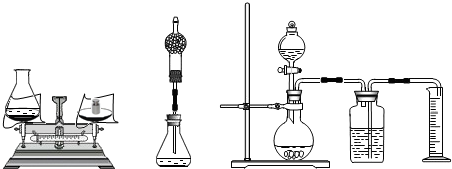
过程方法:
(1)小海首先设计(如图):向装有样品溶液(20g)的锥形瓶(75g)中投入0.5g二氧化锰,待双氧水反应完毕后测得锥形瓶和反应后混合物的总质量为95.1g,则产生氧气的质量是
(2)小林对小海的设计提出质疑后,设计如中图的方案(只在上述方案中的锥形瓶上加一碱石灰干燥管),请你说明小林质疑的理由是
(3)小明通过思考后,觉得他们的方案误差都较大,于是小明设计如右图的方案(试剂用量不变).请你说明小明认为他们误差较大的原因:
(4)小明实验前对该装置进行了气密性检查:打开装置中的活塞,发现分液漏斗中的水
没有流下,于是得出气密性良好的结论.你认为甲同学的检验方法是否可行?
分析:(1)根据质量守恒定律:在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和,进行解答产生氧气的质量;溶液的质量分数为溶质与溶液的比进行解答;
(2)根据碱石灰是强干燥剂,极易吸收水蒸汽和二氧化碳,在锥形瓶上加一碱石灰干燥管,干燥氧气的同时带走水蒸气,进行解答;
(3)根据托盘天平的称量范围,托盘天平的精确度为0.1g,进行分析解答;
(4)根据气密性的检查方法进行解答;根据常温下氧气密度为1.42gL,质量,计算出氧气的体积,选用符号体积的量筒进行解答本题.
(2)根据碱石灰是强干燥剂,极易吸收水蒸汽和二氧化碳,在锥形瓶上加一碱石灰干燥管,干燥氧气的同时带走水蒸气,进行解答;
(3)根据托盘天平的称量范围,托盘天平的精确度为0.1g,进行分析解答;
(4)根据气密性的检查方法进行解答;根据常温下氧气密度为1.42gL,质量,计算出氧气的体积,选用符号体积的量筒进行解答本题.
解答:解:(1)根据质量守恒定律可得:氧气的质量=20+75+0.5-95.1=0.4g;
设双氧水的质量为 x g
2H2O2
2H2O+O2↑
68 32
x 0.4g
=
则x=0.85g;
双氧水溶液中过氧化氢的质量分数=
×100%=4.25%;
故答案为:0.4; 4.25%;
(2)在锥形瓶上加一碱石灰干燥管,干燥氧气的同时带走水蒸气,溶液的质量减小,导致双氧水溶液中过氧化氢的质量偏大;
故答案为:氧气会带走水蒸气,导致结果偏大;
(3)根据托盘天平的称量范围,托盘天平的精确度为0.1g,因此会导致误差较大;
故答案为:托盘天平的精确度为0.1g,误差较大;
(4)打开装置中的活塞,发现分液漏斗中的在气压平衡下,水没有流下,说明气密性良好,方法可行;
氧气的体积=
=282 mL;因此需用500 mL量筒(因为产生氧气的体积约是282 mL).
故答案为:是;需用500 mL量筒(因为产生氧气的体积约是282 mL).
设双氧水的质量为 x g
2H2O2
| ||
68 32
x 0.4g
| 68 |
| x |
| 32 |
| 0.4 |
双氧水溶液中过氧化氢的质量分数=
| 0.85 |
| 20 |
故答案为:0.4; 4.25%;
(2)在锥形瓶上加一碱石灰干燥管,干燥氧气的同时带走水蒸气,溶液的质量减小,导致双氧水溶液中过氧化氢的质量偏大;
故答案为:氧气会带走水蒸气,导致结果偏大;
(3)根据托盘天平的称量范围,托盘天平的精确度为0.1g,因此会导致误差较大;
故答案为:托盘天平的精确度为0.1g,误差较大;
(4)打开装置中的活塞,发现分液漏斗中的在气压平衡下,水没有流下,说明气密性良好,方法可行;
氧气的体积=
| 0.4g |
| 1.42g/L |
故答案为:是;需用500 mL量筒(因为产生氧气的体积约是282 mL).
点评:本题主要考查根据质量守恒定律的计算,溶液溶质的质量分数,仪器的选用,及分析实验现象,找出结论的分析解题能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 2H2O+O2↑;常温下氧气密度为1.42g/L.
2H2O+O2↑;常温下氧气密度为1.42g/L.
