题目内容
小海、小林、小明三同学一起测定双氧水溶液中溶质的质量分数.查阅资料:2H2O2
| ||
设计原理:将一定质量的双氧水样品与二氧化锰混合,测定反应产生的氧气的质量,计算出H2O2的质量,继而得双氧水溶液中溶质的质量分数.
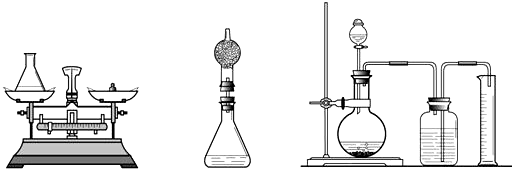
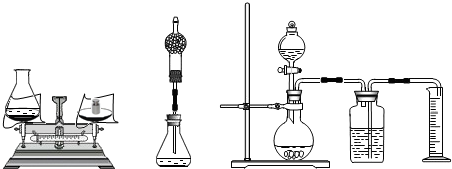
过程方法:(1)小海首先设计(如图):向装有样品溶液(20 g)的锥形瓶(75 g)中投入0.5g二氧化锰,待双氧水反应完毕后测得锥形瓶和反应后混合物的总质量为95.1 g,则产生氧气的质量是

(2)小林对小海的设计提出质疑后,设计如中图的方案(只在上述方案中的锥形瓶上加一干燥管),请你说明小林质疑的理由是
(3)小明通过思考后,觉得他们的方案误差都较大,于是小明设计如右图的方案(试剂用量不变).请你说明小明认为他们误差较大的原因:
分析:(1)根据质量守恒定律可知,装置和药品的总质量在反应中减少的质量,就是生成氧气的质量.由氧气的质量根据过氧化氢分解的化学方程式可以计算出双氧水溶液中过氧化氢的质量分数.
(2)只有保证氧气中不含其它物质,才能减小误差.
(3)只有仪器的精确度高或排除产生误差的因素,才能减小误差.
根据氧气的质量和密度可以计算出氧气的体积,从而确定量筒的量程.
(2)只有保证氧气中不含其它物质,才能减小误差.
(3)只有仪器的精确度高或排除产生误差的因素,才能减小误差.
根据氧气的质量和密度可以计算出氧气的体积,从而确定量筒的量程.
解答:解:(1)根据质量守恒定律可知:反应后生成氧气的质量为20g+75g+0.5g-95.1g=0.4g
设双氧水溶液中过氧化氢的质量分数为x.
2H2O2
2H2O+O2↑
68 32
20g×x 0.4g
=
,
x=4.25%
(2)用小海设计的装置收集到的氧气中含有少量的水蒸气,使计算出的氧气的质量变大,从而会造成误差.
(3)由于托盘天平的精确度为0.1g,读数时产生的误差较大.
由于产生氧气的体积为0.4g÷1.42g/L×1000mL≈282mL,因此应用500mL的量筒.
故答案为:
(1)0.4;4.25%
(2)氧气会带走水蒸气
(3)托盘天平的精确度为0.1g;500.
设双氧水溶液中过氧化氢的质量分数为x.
2H2O2
| ||
68 32
20g×x 0.4g
| 68 |
| 32 |
| 20g×x |
| 0.4g |
x=4.25%
(2)用小海设计的装置收集到的氧气中含有少量的水蒸气,使计算出的氧气的质量变大,从而会造成误差.
(3)由于托盘天平的精确度为0.1g,读数时产生的误差较大.
由于产生氧气的体积为0.4g÷1.42g/L×1000mL≈282mL,因此应用500mL的量筒.
故答案为:
(1)0.4;4.25%
(2)氧气会带走水蒸气
(3)托盘天平的精确度为0.1g;500.
点评:本题主要考查质量守恒定律的应用、化学方程式的计算、减小误差的措施和仪器的选择,难度稍大.

练习册系列答案
相关题目
 2H2O+O2↑;常温下氧气密度为1.42g/L.
2H2O+O2↑;常温下氧气密度为1.42g/L.
