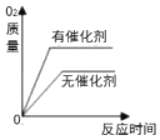
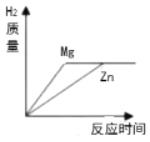
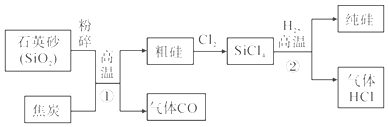
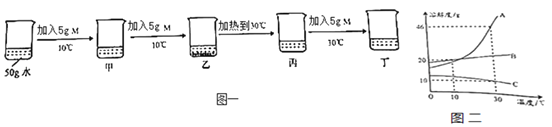
��Ŀ����
����Ŀ��Ϊ�˲ⶨij��������Ʒ���������ĺ��������ʲ�����ˮ�����������ʷ�Ӧ�Ҳ�����Ԫ�أ���ij��ѧС���������ʵ�飺
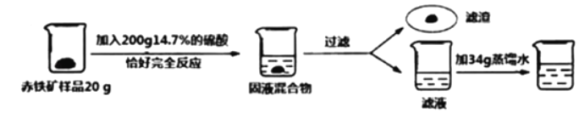
��ش��������⣺
��1��������������98%��Ũ������������ʵ������ϡ���ᣬ����Ũ�����������_____��
��2��������Ӧ�Ļ�ѧ����ʽΪ_____��
��3�����ݼ�֪�����г����������Ӧ����ˮ��������x���ı���ʽ_____��
��4���ó��������������ĺ���Ϊ_____��
��5����������Һ�м���34g����ˮ��������������Һ�����ʵ���������Ϊ_____��
��6������200t���ֳ�����ʯұ��������ұ����������ʧ��Ԫ��5%�������տ����ú���95%������������Ϊ_____��
���𰸡�30g Fe2O3+3H2SO4�TFe2��SO4��3+3H2O ![]() ��54/x����294/54��200g��14.7%/x 80% 16% 112t
��54/x����294/54��200g��14.7%/x 80% 16% 112t
��������
������������98%��Ũ������������ʵ������ϡ���ᣬ����Ũ���������200g��14.7%��98%��30g
�����ķ�ӦΪFe2O3+3H2SO4�TFe2(SO4)3+3H2O
�����ɵ�ˮ������Ϊx��������������Ϊy������������������Ϊz
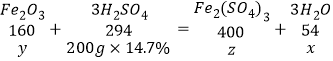
![]() =
=![]() =
=![]() =
=![]()
x��5.4g
y��16g
z��40g
�ó��������������ĺ���Ϊ16g/20g��100%��80%
��������Һ�м���34g����ˮ��������������Һ�����ʵ���������Ϊ![]() ��100%��16%
��100%��16%
����200t���ֳ�����ʯұ��������ұ����������ʧ��Ԫ��5%�������տ����ú���95%������������Ϊ200t��80%��![]() ����1��5%����95%��112t
����1��5%����95%��112t