题目内容
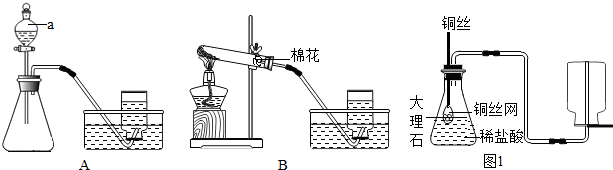
26、如图甲所示试剂瓶中分别盛有三种常见的化学药品,图乙所示的是氧原子结构示意图.

(1)图甲B瓶中的药品的化学式
(2)图乙方框内的数字是
(3)用化学符号和数字表示:2个氧原子

(1)图甲B瓶中的药品的化学式
NaCl
,C瓶中药品的名称硫酸
.(2)图乙方框内的数字是
6
.(3)用化学符号和数字表示:2个氧原子
2O
,3个镁离子3Mg2+
.分析:(1)图甲B瓶中的药品是氯化钠,氯化钠由+1价的钠元素和-1价的氯元素组成;
图甲C瓶中的药品是H2SO4,根据化学式的读法可知其名称是硫酸.
(2)由图可知氧原子核外有8个电子,核外电子排布的规律是:第一层2个电子,第一层排满后还剩6个电子,再排在第二层;第二层排8个电子,第二层排满后再排第三层,第二层仅排了6个电子,没有排满.
(3)表示微粒个数的数字写在符号的前面,表示离子所带电荷数的数字写在符号的右上角.
图甲C瓶中的药品是H2SO4,根据化学式的读法可知其名称是硫酸.
(2)由图可知氧原子核外有8个电子,核外电子排布的规律是:第一层2个电子,第一层排满后还剩6个电子,再排在第二层;第二层排8个电子,第二层排满后再排第三层,第二层仅排了6个电子,没有排满.
(3)表示微粒个数的数字写在符号的前面,表示离子所带电荷数的数字写在符号的右上角.
解答:解:(1)图甲B瓶中的药品是氯化钠,氯化钠由+1价的钠元素和-1价的氯元素组成,因此氯化钠的化学式为NaCl;
图甲C瓶中的药品是H2SO4,根据化学式的读法可知其名称是硫酸.
(2)由图可知氧原子核外有8个电子,核外电子排布的规律是:第一层2个电子,第一层排满后还剩6个电子,再排在第二层;第二层排8个电子,第二层排满后再排第三层,第二层仅排了6个电子,没有排满,因此图乙方框内的数字是6.
(3)表示微粒个数的数字写在符号的前面,表示离子所带电荷数的数字写在符号的右上角.氧原子用氧的元素符号来表示,因此2个氧原子表示为2O.1个镁离子带2个单位的正电荷,因此镁离子的离子符号为Mg2+,所以3个镁离子表示为3Mg2+.
故答案为:(1)NaCl;硫酸.(2)6.(3)2O;3Mg2+.
图甲C瓶中的药品是H2SO4,根据化学式的读法可知其名称是硫酸.
(2)由图可知氧原子核外有8个电子,核外电子排布的规律是:第一层2个电子,第一层排满后还剩6个电子,再排在第二层;第二层排8个电子,第二层排满后再排第三层,第二层仅排了6个电子,没有排满,因此图乙方框内的数字是6.
(3)表示微粒个数的数字写在符号的前面,表示离子所带电荷数的数字写在符号的右上角.氧原子用氧的元素符号来表示,因此2个氧原子表示为2O.1个镁离子带2个单位的正电荷,因此镁离子的离子符号为Mg2+,所以3个镁离子表示为3Mg2+.
故答案为:(1)NaCl;硫酸.(2)6.(3)2O;3Mg2+.
点评:本题主要考查离子符号和化学式的书写及核外电子的排布规律,难度较小.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
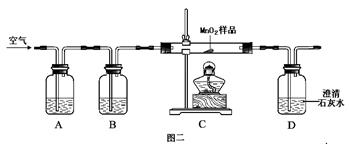
(5分)实验室有瓶黑色粉末药品,标签为MnO2,化学小组同学在加热该药品时,发现有气泡产生(如图一所示),于是他们对这个异常现象进行了探究。
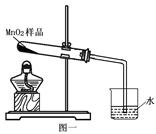
(1)对气体成分的探究:加热二氧化锰样品,用燃着的木条靠近试管口,木条熄灭。将气体通入澄清的石灰水,发现石灰水变浑浊,产生的气体是 。
(2)对气体来源的探究:
【假设1】甲同学认为:该气体来自于试管中的空气,请你设计实验证明该假设不成立
|
实验步骤及现象 |
结论 |
|
|
假设不成立。 |
【假设2】乙同学认为:二氧化锰样品中可能混有炭粉,炭粉发生反应生成了该气体。他设计了如图二所示的实验进行研究,其中B装置的作用是检验A中反应是否完全,B中的试剂是 ,实验中观察到D处澄清石灰水变浑浊,D中发生反应的化学方程式是 。他又用氮气代替空气(氮气不参与该实验中的任何反应),重复上述实验,发现D处澄清的石灰水也变浑浊。
【结论】通过乙同学的实验证明,二氧化锰中混有炭粉,炭粉与 反应产生了这种气体。