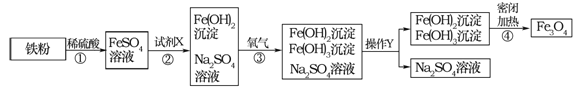
题目内容
【题目】现甲、乙两化学小组安装两套如下相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素。
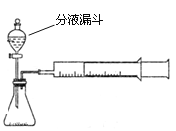
(1) 下列方法能检查该装置气密性的是______。
![]()
![]() A、将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分液漏斗颈部能形成稳定的水柱,则气密性良好,反之气密性差。
A、将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分液漏斗颈部能形成稳定的水柱,则气密性良好,反之气密性差。
B、关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移(右移),停止加热后注射器活塞回到原来位置,则气密性良好,反之气密性差。
C、关闭分液漏斗活塞,用力将注射器活塞外移(右移),停止用力后,注射器活塞不移动,则气密性良好,反之气密性差。
(2)MnO2催化下H2O2分解的化学方程式是 。
(3)甲小组有如下实验设计方案,完成下表。
实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
甲组实验Ⅰ | 探究 对H2O2分解速率的影响 | 25℃ | 二氧化锰 | 10mL 2%H2O2 |
甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 |
(4)甲、乙两小组得出如图数据。
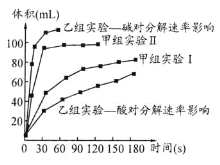
①甲组实验得出的数据可知:浓度越大,H2O2分解速率 ;
②由乙组研究的酸、碱对H2O2分解影响因素的 数据分析:相同条件下, H2O2在 (填“酸”或“碱”)性环境下放出气体速率较快;乙组提出可以用Ba02固体与硫酸溶液反应制H2O2(已知还生成另一种物质),其化学反应方程式为 ;支持这一方案的理由是 。
【答案】(1)AB;
(2)2H2O2MnO22H2O+O2↑;
(3)浓度;
(4)①越快;
②碱(1分);
BaO2 +H2SO4= BaSO4 ↓+H2O2;
过氧化氢在酸性环境下分解较慢
【解析】
试题分析:(1)A、打开分液漏斗活塞,由于瓶内气压增大到一定程度后会使分液漏斗颈部能形成稳定的水柱,可说明气密性良好。此项正确。B、关闭分液漏斗活塞,加热锥形瓶,瓶内气体因受热而膨胀会造成注射器活塞右移。停止加热后瓶内温度降低,注射器活塞回到原来位置。此项正确。C、关闭分液漏斗活塞,用力将注射器活塞外移(右移),停止用力后,注射器活塞不移动可说明瓶内气体在拉的过程中气压没有减小,即装置漏气、气密性差。此项不正确。所以应选AB项。
(2)MnO2催化下H2O2分解的化学方程式是2H2O2MnO22H2O+O2↑。
(3)甲小组的两个实验中只有过氧化氢的浓度不同,所以其目的是探究浓度对H2O2分解速率的影响。
⑷甲组实验Ⅱ比Ⅰ所用的过氧化氢的浓度大,根据图像判断Ⅱ反应速度要快于Ⅰ。所以Ⅰ以得出结论:浓度越大,H2O2分解速率越快。
②根据乙组的图像可知:相同条件下,H2O2在碱性环境下放出气体速率较快;
根据题意可知:反应物为Ba02固体与硫酸溶液,生成物H202。根据质量守恒定律可知所以另一种生成物为钡和硫酸根形成的硫酸钡,化学反应方程式为BaO2 +H2SO4= BaSO4 ↓+H2O2;该方案反应物中有硫酸铜,可形成酸性反应环境,结合过氧化氢在酸性环境下分解较慢这一事实可判断该方案成立。

 名校课堂系列答案
名校课堂系列答案【题目】(13分)掌握化学用语和物质的分类是学习化学的基础,请按要求回答下列问题。
(1)填写下列表格
元素的原子序数 | 原子结构示意图 | 该元素简单离子符号 |
11 | ||
16 |
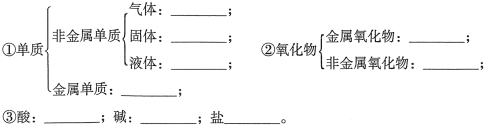
(2)将下列物质的化学式填写在对应类别空格上(注:未提供对应类别物质的,空格不填)
物质:金刚石,氮气,三氧化硫,氧化铝,硫酸镁,醋酸,氢氧化钾,铜,氦气
【题目】家庭生活中一些常见物质的pH如下:
物质 | 食醋 | 牛奶 | 食盐水 | 牙膏 | 肥皂水 |
pH | 2~3 | 6~7 | 7 | 8~9 | 9~10 |
当我们被蚊虫叮咬后,蚊虫能在人的皮肤内分泌蚁酸(具有酸的性质),从而使皮肤肿痛。要减轻痛痒,应在叮咬处涂抹下列物质中的 ( )
A.食醋 B.牛奶 C.食盐水 D.牙膏或肥皂水