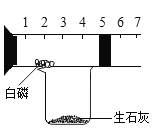
题目内容
【题目】在宏观、微观和符号之间建立联系是化学学科的特点。
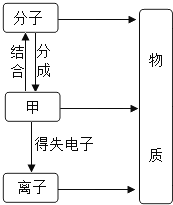
(1)构成物质的粒子之间的关系如图所示:
①甲是______。②在铁、二氧化碳和硫酸铜三种物质中,由离子构成的物质是______,保持二氧化碳化学性质的最小粒子是______(填具体粒子名称)。
(2)A是钙原子的结构示意图,B、C、D、E分别是四种粒子的结构示意图。

① A中x=______。
② B、C、D、E属于_____种元素的粒子;其中属于阳离子的是_____(填字母)。
③ D元素的相对原子质量为19,则其原子核内中子数为______。C元素与D元素形成化合物的化学式是_______。
④ B、C、D、E四种粒子中与A粒子化学性质相似的是_______(填字母)。
【答案】原子 硫酸铜 二氧化碳分子 8 3 C 10 MgF2 E
【解析】
(1)构成物质的粒子包括:分子、原子和离子,原子结合成分子,原子得失电子形成离子,分子是保持物质化学性质的最小粒子,则:
①甲是原子。
②铁由原子构成,二氧化碳由分子构成,硫酸铜由离子构成,保持二氧化碳化学性质的最小粒子是二氧化碳分子。
(2)A是钙原子的结构示意图,B是氦原子结构示意图,C是镁离子结构示意图,D是氟原子结构示意图,E是镁原子结构示意图,则:
① A中![]() 。
。
② 元素指的是具有相同和电荷数的一类原子的统称,B、C、D、E属于3种元素的粒子;其中属于阳离子的是C。
③ D元素的相对原子质量为19,则其原子核内中子数为相对原子质量-质子数,即![]() 。C元素与D元素形成化合物为氟化镁,化学式是
。C元素与D元素形成化合物为氟化镁,化学式是![]() 。
。
④ 元素原子最外层电子数相同,化学性质相似,B、C、D、E四种粒子中与A粒子化学性质相似的是E。

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目