题目内容
化学实验室的开放日,老师安排化学兴趣小组的同学开展了有关NaCl和Na2CO3这两种常见的盐的实验,实验任务如下:第一小组的同学:将失去标签的两瓶无色溶液(分别为NaCl和Na2CO3)区别开来
第二小组的同学:除去NaCl固体中的少量Na2CO3
(1)第一小组的同学为了区别两瓶无色溶液,甲、乙、丙、丁四位同学分别选择下列物质进行实验.其中合理的是______(填写序号).
甲:稀盐酸 乙:AgNO3溶液 丙:澄清石灰水 丁:蓝色的石蕊试纸
(2)第二小组为了除去NaCl溶液中的少量Na2CO3,设计了如下的实验:
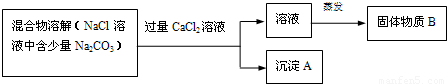
请回答下列问题:
①写出沉淀A的化学式______;②甲同学认为:加入CaCl2溶液后,分离除去沉淀A的实验操作方法是______;③乙同学发现此方案很容易引入新的杂质,他们提出新的方案:将混合物溶解,若滴加盐酸至不再产生气体为止,则既能除去Na2CO3杂质,又能有效地防止新杂质的引入.写出有关反应的方程式______.
【答案】分析:(1)可根据碳酸钠的化学性质即与酸反应产生二氧化碳气体、与澄清石灰水反应产生沉淀、其水溶液显碱性来鉴别;
(2)上述流程图中,分析样品中的Na2CO3与Ca(OH)2溶液反应即得结果;分析样品中的Na2CO3与盐酸反应的产物根据除杂的要求并能写出碳酸钠与盐酸反应的化学方程式即可;
解答:解:(1)鉴别失去标签的Na2CO3溶液和NaCl溶液.分别选择了下列物质进行实验甲:稀盐酸 乙:AgNO3溶液 丙:澄清石灰水 丁:蓝色的石蕊试纸其中合理的是:甲、丙;因为:Na2CO3溶液能与稀盐酸反应生成二氧化碳气体,有明显现象,却不与NaCl溶液反应;Na2CO3溶液能和澄清石灰水反应产生沉淀,有明显现象,硝酸银与氯化钠以及碳酸钠均能反应生成白色沉淀;Na2CO3溶液显碱性,所以无法采用蓝色的石蕊试纸验证溶液的碱性;
(2)①上述流程图中知,碳酸钠能和过量的石灰水反应生成沉淀物,沉淀的化学式为CaCO3;
②加入CaCl2溶液后,分离除去沉淀A的实验操作是分离液体与固体的混合物,所以该操作是过滤;③因为样品中的Na2CO3溶液与盐酸反应时会生成氯化钠、水和二氧化碳,将混合物溶解,若滴加盐酸至不再产生气体为止,则能除掉样品中的碳酸钠又不引入新的杂质;反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑;
故答案为:(1)甲、丙;(2)①CaCO3;②过滤;③Na2CO3+2HCl═2NaCl+H2O+CO2↑;
点评:此题涉及到实验的常规操作,相关的物质的分离等,纵纵观这些方式的考查实际还是与物质之间的反应有关系,因此学好物质间的联系是酸碱盐知识的关键.
(2)上述流程图中,分析样品中的Na2CO3与Ca(OH)2溶液反应即得结果;分析样品中的Na2CO3与盐酸反应的产物根据除杂的要求并能写出碳酸钠与盐酸反应的化学方程式即可;
解答:解:(1)鉴别失去标签的Na2CO3溶液和NaCl溶液.分别选择了下列物质进行实验甲:稀盐酸 乙:AgNO3溶液 丙:澄清石灰水 丁:蓝色的石蕊试纸其中合理的是:甲、丙;因为:Na2CO3溶液能与稀盐酸反应生成二氧化碳气体,有明显现象,却不与NaCl溶液反应;Na2CO3溶液能和澄清石灰水反应产生沉淀,有明显现象,硝酸银与氯化钠以及碳酸钠均能反应生成白色沉淀;Na2CO3溶液显碱性,所以无法采用蓝色的石蕊试纸验证溶液的碱性;
(2)①上述流程图中知,碳酸钠能和过量的石灰水反应生成沉淀物,沉淀的化学式为CaCO3;
②加入CaCl2溶液后,分离除去沉淀A的实验操作是分离液体与固体的混合物,所以该操作是过滤;③因为样品中的Na2CO3溶液与盐酸反应时会生成氯化钠、水和二氧化碳,将混合物溶解,若滴加盐酸至不再产生气体为止,则能除掉样品中的碳酸钠又不引入新的杂质;反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑;
故答案为:(1)甲、丙;(2)①CaCO3;②过滤;③Na2CO3+2HCl═2NaCl+H2O+CO2↑;
点评:此题涉及到实验的常规操作,相关的物质的分离等,纵纵观这些方式的考查实际还是与物质之间的反应有关系,因此学好物质间的联系是酸碱盐知识的关键.

练习册系列答案
相关题目