题目内容
【题目】已知氯化镁样品中含有杂质氯化钠,某化学兴趣小组的同学通过以下实验测定其中氯化镁的质量分数:称取该样品15g溶于水得到溶液,然后将一定溶质质量分数的氢氧化钠溶液100g平均分四次加入其中,充分振荡(实验数据见下表)。
第1次 | 第2次 | 第3次 | 第4次 | |
加入氢氧化钠溶液的质量/g | 25 | 25 | 25 | 25 |
生成沉淀的质量/g | 2.9 | x | 8.7 | 8.7 |
(1)表中x = 。
(2)样品中氯化镁的质量分数是 。
(3)若实验室中只有80g质量分数为30%的氢氧化钠溶液,要想配成本实验所需溶质质量分数的氢氧化钠溶液,还需加入水的质量是多少?
【答案】(1) 5.8 (2) 95% (3) 70g
【解析】
试题分析:(1)根据表格数据可知第三次加入氢氧化钠溶液恰好完全反应,第一次为2.9g,那么第二次产生的沉淀的质量=2.9g+2.9g=5.8g,第三次产生加入氢氧化钠产生沉淀的质量=5.8g+2.9g=8.7g;
根据生成的沉淀质量,利用化学方程式氯化镁与氢氧化镁的质量比即可求出氯化镁的质量;
解:设25g氢氧化钠溶液中含氢氧化钠的质量为x ;第一次参加反应氯化镁的质量为y。
MgCl2 + 2NaOH = Mg(OH)2↓+2NaCl
95 80 58
Y x 2.9g
80:x = 58:2.9g 95:y = 58:2.9g
解得,x=4g y=4.75g
样品中氯化镁的质量=4.75g×3=14.25g
样品中氯化镁的质量分数=14.25g/15g ×100% =95%
则本实验所需氢氧化钠溶液的质量分数为![]() ×100%=16%,
×100%=16%,
设需要加水的质量为z
80g×30% =(80g + z)×16%
解得z=70g
答:还需加入水的质量是70g。

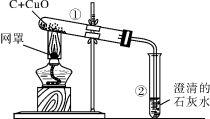
【题目】某兴趣小组同学对实验室制备氧气的条件进行如下探究实验.
【提出问题】①氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【设计并完成实验】
Ⅰ.将3.0g氯酸钾放在试管中加热
Ⅱ.将3.0g氯酸钾与1.0g二氧化锰均匀混合加热
Ⅲ.将x g氯酸钾与1.0g氯化铜均匀混合加热
【实验现象分析】
Ⅲ中x的值应为 ,将实验Ⅰ和Ⅲ比较可证明 ,将实验Ⅲ反应后的固体加水溶解、过滤、洗涤、干燥,若称量得到1.0g黑色粉末,再将黑色粉末和xg氯酸钾混合加热,现象与实验Ⅲ相同,此步骤是为了证明氧化铜在该化学反应前后 和 都不变.
【结论】氧化铜还能作氯酸钾分解的催化剂,请写出实验Ⅲ中的化学反应文字表达式
【实验反思】实验Ⅱ和Ⅲ对比是为了证明
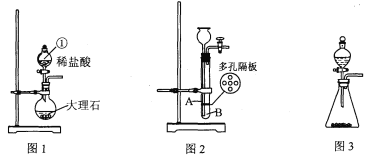
【提出问题】②双氧水分解速度还和什么因素有关
【设计并完成实验】
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生产生O2体积 | |
Ⅰ | 50.0g | 1% | 0.1g | 9mL |
Ⅱ | 50.0g | 2% | 0.1g | 16mL |
Ⅲ | 50.0g | 4% | 0.1g | 31mL |
本实验中,测量O2体积的装置是 (填编号)
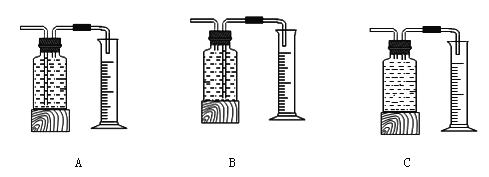
【结论】在相同条件下,双氧水的浓度越大,双氧水分解得越 。