题目内容
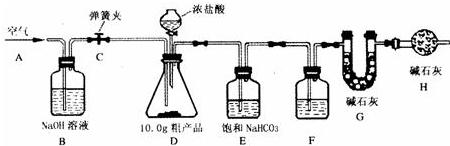
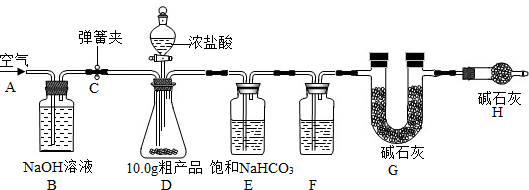
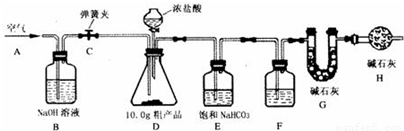
已知某纯碱粗产品仅含有NaCl杂质,为测定该纯碱粗产品中纯碱的质量分数,某兴趣小组的同学设计了如图所示的实验装置,取10、0g粗产品进行实验.
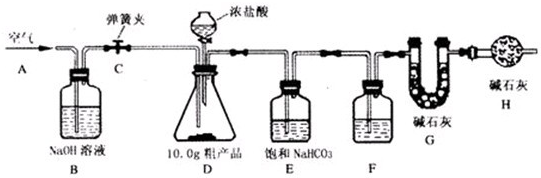
(说明)碱石灰是CaO与NaOH 的固体混合物,能吸收水和二氧化碳.E装置中的饱和NaHCO3溶液是为了除去二氧化碳气体中的氯化氢,发生的反应为NaHCO3 十HCl=NaCl十CO2↑十H2O.
实验主要操作步骤如下:
①连接好装置,检查气密性;②打开弹簧夹C,在A处缓缓通入一段时间空气;③称量 G的质量;④关闭弹簧夹C,慢慢滴加浓盐酸至过量,直至D中无气泡冒出;⑤打开弹簧夹C,再次缓缓通入一段时间空气;⑥再次称量 G的质量,测得质量增加了0、48g.
请回答下列问题
(1)F中的试剂应为
(2)B装置的作用是
(3)事实上10.0g粗产品只能产生0.40g CO2.请你仔细分析上述实验,解释G的质量增加了0.48g的原因(假设操作均正确)

(说明)碱石灰是CaO与NaOH 的固体混合物,能吸收水和二氧化碳.E装置中的饱和NaHCO3溶液是为了除去二氧化碳气体中的氯化氢,发生的反应为NaHCO3 十HCl=NaCl十CO2↑十H2O.
实验主要操作步骤如下:
①连接好装置,检查气密性;②打开弹簧夹C,在A处缓缓通入一段时间空气;③称量 G的质量;④关闭弹簧夹C,慢慢滴加浓盐酸至过量,直至D中无气泡冒出;⑤打开弹簧夹C,再次缓缓通入一段时间空气;⑥再次称量 G的质量,测得质量增加了0、48g.
请回答下列问题
(1)F中的试剂应为
浓H2SO4
浓H2SO4
.(2)B装置的作用是
吸收空气中的CO2
吸收空气中的CO2
,B装置中发生反应的化学方程式为CO2+2NaOH=Na2CO3+H2O
CO2+2NaOH=Na2CO3+H2O
.(3)事实上10.0g粗产品只能产生0.40g CO2.请你仔细分析上述实验,解释G的质量增加了0.48g的原因(假设操作均正确)
防止空气中的CO2和H2O被G装置吸收
防止空气中的CO2和H2O被G装置吸收
.分析:(1)为防止水对装置G中碱石灰的影响,气体进入装置G前应进行干燥处理,所以,装置F应加入液体干燥剂;
(2)装置B内盛放的氢氧化钠溶液能吸收空气中的二氧化碳,当向装置内通入空气时,装置B中的氢氧化钠可以把空气中二氧化碳除去而避免了二氧化碳对实验的影响;
(3)对比探究实验中所得二氧化碳质量与实际可得二氧化碳的质量,分析造成实验探究中二氧化碳气体质量偏大的操作原因.
(2)装置B内盛放的氢氧化钠溶液能吸收空气中的二氧化碳,当向装置内通入空气时,装置B中的氢氧化钠可以把空气中二氧化碳除去而避免了二氧化碳对实验的影响;
(3)对比探究实验中所得二氧化碳质量与实际可得二氧化碳的质量,分析造成实验探究中二氧化碳气体质量偏大的操作原因.
解答:解:(1)为防止水对G装置中碱石因吸收水而影响对二氧化碳质量的测定,需要在装置G前用浓硫酸吸收气体中的水;所以,装置F中应加入浓硫酸;
(2)二氧化碳与氢氧化钠反应生成碳酸钠和水;装置B中的氢氧化钠溶液吸收空气中的二氧化碳,避免了空气中的二氧化碳会对实验中二氧化碳质量的产生影响;
(3)事实上10.0g粗产品只能产生0.44g CO2,而在探究过程中所称得的二氧化碳质量却为了0.48g>0.44g,说明实验过程中还存在产生二氧化碳的反应;使用盐酸与样品反应时,产生的气体二氧化碳中混有挥发出的HCl气体,该气体通入碳酸氢钠溶液时发生反应产生的二氧化碳使得测定结果偏大;
故答案为:(1)浓H2SO4.
(2)吸收空气中的CO2,CO2+2NaOH=Na2CO3+H2O.
(3)装置D中浓盐酸挥发出的氯化氢与装置E中NaHCO3反应产生二氧化碳.
(2)二氧化碳与氢氧化钠反应生成碳酸钠和水;装置B中的氢氧化钠溶液吸收空气中的二氧化碳,避免了空气中的二氧化碳会对实验中二氧化碳质量的产生影响;
(3)事实上10.0g粗产品只能产生0.44g CO2,而在探究过程中所称得的二氧化碳质量却为了0.48g>0.44g,说明实验过程中还存在产生二氧化碳的反应;使用盐酸与样品反应时,产生的气体二氧化碳中混有挥发出的HCl气体,该气体通入碳酸氢钠溶液时发生反应产生的二氧化碳使得测定结果偏大;
故答案为:(1)浓H2SO4.
(2)吸收空气中的CO2,CO2+2NaOH=Na2CO3+H2O.
(3)装置D中浓盐酸挥发出的氯化氢与装置E中NaHCO3反应产生二氧化碳.
点评:采取化学变化测定混合物中某组成成分的含量时,对反应中某物质质量的测量将直接影响最终的探究结果.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目