题目内容
【题目】某兴趣小组运用化学知识进行系列实验。
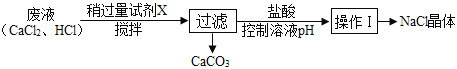
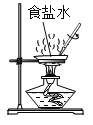
①如图所示,蒸发食盐水时,玻璃棒的作用是________。
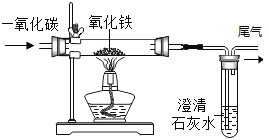
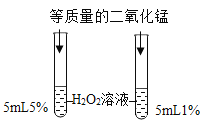
②如图所示,两支试管内产生气泡的速率不同,由此可知影响过氧化氢分解速率的因素是_。
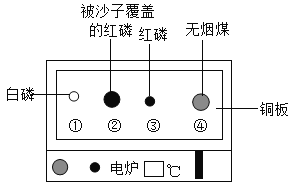
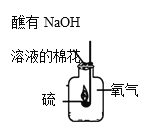
③如图所示,对教材中硫在氧气中燃烧的实验进行了改进,硫在氧气中燃烧的实验现象是___,改进实验的优点是___。
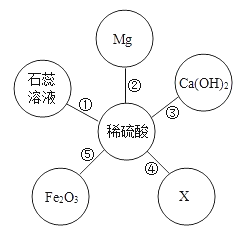
④某同学为了探究相关金属的化学性质,做了下列实验:
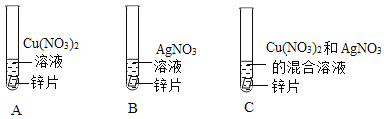
Ⅰ实验a试管中反应的化学方程式为__。
Ⅱ只通过实验a和实验b尚不能证明铜、银的活动性强弱,需补充一个实验来证明,补充实验所用的试剂有___。
Ⅲ实验c中物质充分反应后过滤,滤液为蓝色,则判断正确的是____(填序号)。
A 滤渣中一定有银,可能有铜
B 滤液中一定有硝酸锌、硝酸铜、硝酸银
C 滤渣中一定有银和锌,可能有铜
D 滤液中一定有硝酸锌、硝酸铜,可能有硝酸银
【答案】使液体均匀受热,防止液体飞溅 过氧化氢溶液的溶质质量分数 发出明亮的蓝紫色火焰,放出热量,生成具有刺激性气味的气体 减少二氧化硫逸出,防止污染空气 Fe+ Cu(NO3)2 =Fe(NO3)2 + Cu 铜、硝酸银溶液 或 银、硝酸铜溶液(其他合理即可)(化学式表示要正确) A D (错、漏不给分)
【解析】
①蒸发食盐水时,玻璃棒的作用是使液体均匀受热,防止液体飞溅;
②如图所示,两支试管内产生气泡的速率不同,形成对照的两个实验,只有过氧化氢溶液的浓度不同,根据控制变量原则,可知影响过氧化氢分解速率的因素是过氧化氢溶液的溶质质量分数;
③硫在氧气中燃烧的实验现象是发出明亮的蓝紫色火焰,生成有刺激性气味的气体,放出大量的热,改进实验的优点是生成的二氧化硫能被湿润的棉花上的氢氧化钠吸收,减少二氧化硫逸出,防止污染空气;
④Ⅰ、实验a试管中反应是铁和硝酸铜反应生成硝酸亚铁和铜,化学方程式为Fe+ Cu(NO3)2 =Fe(NO3)2 + Cu;
Ⅱ、通过实验a能证明铁的活动性比铜的强,实验b能证明铁的活动性比银的强,尚不能证明铜、银的活动性强弱,需补充一个实验来证明,补充实验所用的试剂有铜、硝酸银溶液或 银、硝酸铜溶液(其他合理即可),铜与硝酸银反应,或银不与硝酸铜反应都证明铜的活动性比银的强;
Ⅲ、锌、铜、银三种金属的活动性顺序是:锌>铜>银,所以,锌先和硝酸银反应生成银和硝酸锌,剩余的锌再与硝酸铜反应生成铜和硝酸锌,实验c中物质充分反应后过滤,滤液为蓝色,说明硝酸铜有剩余,硝酸银可能完全反应,也可能有剩余,硝酸铜可能没有发生反应,也可能是发生了反应,但有剩余;
A 滤渣中一定有银,可能有铜,选项正确;
B 滤液中一定有硝酸锌、硝酸铜,可能有硝酸银,选项错误;
C 滤渣中一定有银,可能有铜,一定没有锌,选项错误;
D 滤液中一定有硝酸锌、硝酸铜,可能有硝酸银,选项正确。
故选AD。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案