题目内容
【题目】一包白色固体中可能含有碳酸钠、硫酸钠、氯化钾、硝酸钡、氢氧化钠中的一种或几种.某小组为探究其成分进行如下实验:
Ⅰ. 取少量固体于烧杯中逐渐加水并不断搅拌,烧杯中固体质量随加入的水的质量变化如图1所示
Ⅱ. 取少量B点时的清液于试管中,滴加酚酞溶液,酚酞变红
Ⅲ. 向实验Ⅰ所得的混合物中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸的质量的变化如图2所示.
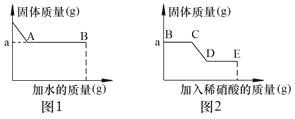
① CD段可观察到的现象是 ,从D到E的溶液的pH (填“增加”、“减小”、“不变”).
② 根据上述实验得出原固体中一定有 .
③ 为进一步探究该白色固体成分,进行如下实验
步骤 | 现象 | 结论 |
取实验Ⅱ反应后的溶液于试管中, | | 原固体中有氢氧化钠 |
取实验Ⅱ反应后的溶液于试管中, | | |
【答案】①固体减少,固体表面有气泡产生 减小 ②碳酸钠、硫酸钠、硝酸钡
③步骤:过量硝酸钡 现象:溶液红色不褪去
现象:红色褪去,无白色沉淀(红色退去,产生白色沉淀) 结论:无氯化钾(可能有氯化钾)
【解析】试题分析:根据实验步骤Ⅰ、取少量固体于烧杯中逐渐加水并不断搅拌,烧杯中固体质量随加入的水的质量变化如图1所示,固体并没有全部溶解,说明反应生成了沉淀,故可判断一定含有硝酸钡,可能含有碳酸钠、硫酸钠中或两种,结合图②,再固体中加入稀硝酸,固体部分溶解,说明沉淀中既有碳酸钡,又有硫酸钡;同时又有刚加入稀硝酸时,沉淀并没有溶解,说明溶液中还含有氢氧化钠
①CD段发生的反应是碳酸钡沉淀与稀硝酸反应,故可观察到的现象是固体减少,固体表面有气泡产生D点表示反应结束,故从D到E是不断加入稀硝酸,酸性增强,故溶液的pH减小
②根据上面分析,原固体中一定有:碳酸钠、硫酸钠、硝酸钡
③取实验Ⅱ反应后的溶液于试管中,加入过量硝酸钡,现象:溶液红色不褪去,说明溶液中除了碳酸钠溶液外,还含有显碱性的物质,即氢氧化钠,故结论:原固体中有氢氧化钠
要证明是否含有氯化钾,应抓住氯离子的鉴定方法:能与硝酸银溶液反应生成不溶于酸的白色沉淀,故步骤取实验Ⅱ反应后的溶液于试管中,加入过量硝酸酸化,再加入硝酸银;现象:红色褪去,无白色沉淀(红色退去,产生白色沉淀),结论:无氯化钾(可能有氯化钾)

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案