题目内容
【题目】将一定质量的NaCl和Na2SO4固体混合物完全溶于100g水后,加入一定质量分数的BaCl2溶液208g,恰好完全反应,过滤.得到23.3g沉淀,经测定滤液中含氯元素的质量为21.3g(不考虑过滤过程中物质质量的损失),计算:
(1)所加BaCl2溶液的溶质质量分数.
(2)原固体混合物中Na2SO4的质量.
(3)求所得溶液的溶质质量分数.(计算结果精确到0.1%)
【答案】(1)10%(2)14.2g(3)10.9%
【解析】
氯化钠不能和氯化钡反应,硫酸钠和氯化钡反应生成白色沉淀硫酸钡和氯化钠,根据反应的化学方程式及其提供的数据可以进行相关方面的计算和判断.
(1)设氯化钡质量为x,硫酸钠质量为y,生成氯化钠的质量为z,
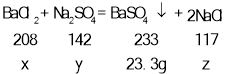
![]()
x=20.8g,y=14.2g,z=11.7g,
所加BaCl2溶液的溶质质量分数为:![]() ×1005=10%,
×1005=10%,
答:所加BaCl2溶液的溶质质量分数为10%.
(2)答:原固体混合物中Na2SO4的质量是14.2g.
(3)滤液中含氯元素的质量为21.3g,则滤液中氯化钠质量为:21.3g÷(![]() ×100%)=35.1g,
×100%)=35.1g,
NaCl和Na2SO4固体混合物中氯化钠质量为:35.1g﹣11.7g=23.4g,
所得溶液的质量为:23.4g+14.2g+100g+208g﹣23.3g=322.3g,
所得溶液的溶质质量分数为:![]() ×100%=10.9%,
×100%=10.9%,
答:所得溶液的溶质质量分数为10.9%.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】某燃煤发电厂开始运行后,该厂附近玉米产量急剧下降.经检测发现:当地雨水pH约4.0.土壤pH约5.0.已知一些主要作物最适宜生长的土壤的pH如表:
作物 | 水稻 | 小麦 | 玉米 | 油菜 | 马铃薯 |
pH | 6~7 | 6.3~7.5 | 6~7 | 6~7 | 4.8~5.5 |
(1)根据数据,该土壤最适合种植的作物是_____.
(2)若继续种玉米,你认为最好选用下列_____试剂来改良土壤.
A 硝酸钾 B 熟石灰 C 石灰石 D 尿素
(3)该地区形成酸雨的主要原因为燃煤中产生的_____所致.
(4)下列防止空气污染的措施中,错误的是_____.
A 大量植树造林 B 控制烟花爆竹燃放
C 开发和利用清洁能源 D 垃圾运到远离城市再焚烧
(5)为减少二氧化碳等温室气体的排放,科学家采取“组合转化”技术,将二氧化碳和氢气在催化剂和加热条件下转化为一种重要的化工原料乙烯(C2H4)和水,该反应的化学方程式为_____.