题目内容
现有一包白色粉末,可能由NaCl、Na2SO4、Na2CO3、CuSO4中的一种或几种组成. 现做如下实验:①取少量粉末,加水溶解得无色溶液;②另取少量粉末,滴加稀盐酸,无明显现象.请回答:
(1)由实验①可确定原粉末中一定没有
(2)为进一步确定原粉末的组成,另取少量粉末按下图所示进行实验:[在AgNO3、Ba(NO3)2、BaCl2溶液中选择两种作为A、B试剂,且A、B的阳离子不同]
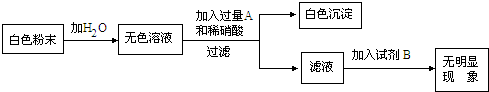
原粉末的成分是
无色溶液和试剂A反应的反应的化学方程式为
(1)由实验①可确定原粉末中一定没有
CuSO4
CuSO4
;由实验②可确定原粉末中一定没有Na2CO3
Na2CO3
.(2)为进一步确定原粉末的组成,另取少量粉末按下图所示进行实验:[在AgNO3、Ba(NO3)2、BaCl2溶液中选择两种作为A、B试剂,且A、B的阳离子不同]

原粉末的成分是
Na2SO4
Na2SO4
;无色溶液和试剂A反应的反应的化学方程式为
Ba(NO3)2+Na2SO4═BaSO4↓+2NaNO3
Ba(NO3)2+Na2SO4═BaSO4↓+2NaNO3
.分析:(1)根据铜离子在溶液中显蓝色进行分析,根据碳酸根离子和盐酸会产生气体进行分析,
(2)要确定原粉末的成份,也就是要检验Cl-和SO42-的存在情况,要注意两种离子的检验顺序,应先用钡离子检验是否有硫酸根离子,若有并将其除去,再用银离子检验Cl-.
(2)要确定原粉末的成份,也就是要检验Cl-和SO42-的存在情况,要注意两种离子的检验顺序,应先用钡离子检验是否有硫酸根离子,若有并将其除去,再用银离子检验Cl-.
解答:解:(1)因为铜离子在溶液中显蓝色,粉末加水得到的是无色溶液,所以一定没有硫酸铜;因为碳酸根离子和盐酸会产生气体,粉末中加盐酸,无明显现象,所以一定没有碳酸钠;
(2)要知道原粉末的成份,也就是检验Cl-和SO42-是否存在,而检验Cl-需加入Ag+,检验SO42-需加入Ba2+;若先加入Ag+检验Cl-,Cl-遇到Ag+会生成氯化银沉淀,溶液浑浊,Ag+遇到SO42-生成的硫酸银微溶于水,也会造成溶液浑浊,因此必须先加入钡离子检验SO42-,并且要加入过量的Ba2+把SO42-全部除去,否则SO42-会对Cl-的检验造成干扰;不能加入氯化钡,因为加入氯化钡也就加入了Cl-,即使原溶液中没有Cl-现在也加入了Cl-,因此只能使用硝酸钡检验是否含有硫酸钠,再加硝酸银检验是否含有氯化钠;根据题中的现象可知原粉末中只有硫酸钠.
故答案为:(1)CuSO4; Na2CO3;(2)Na2SO4;Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3.
(2)要知道原粉末的成份,也就是检验Cl-和SO42-是否存在,而检验Cl-需加入Ag+,检验SO42-需加入Ba2+;若先加入Ag+检验Cl-,Cl-遇到Ag+会生成氯化银沉淀,溶液浑浊,Ag+遇到SO42-生成的硫酸银微溶于水,也会造成溶液浑浊,因此必须先加入钡离子检验SO42-,并且要加入过量的Ba2+把SO42-全部除去,否则SO42-会对Cl-的检验造成干扰;不能加入氯化钡,因为加入氯化钡也就加入了Cl-,即使原溶液中没有Cl-现在也加入了Cl-,因此只能使用硝酸钡检验是否含有硫酸钠,再加硝酸银检验是否含有氯化钠;根据题中的现象可知原粉末中只有硫酸钠.
故答案为:(1)CuSO4; Na2CO3;(2)Na2SO4;Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3.
点评:在解此类题时,先根据题中的现象确定存在或不存在的物质,然后再设计实验验证没法确定的物质;还需要注意混合物中Cl-和SO42-的检验顺序:由于Ag+和SO42-能形成微溶于水的硫酸银造成溶液浑浊,干扰了溶液中Cl-的检验,所以一定要先检验SO42-,再检验Cl-.

练习册系列答案
相关题目