题目内容
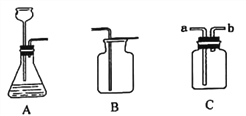
【题目】某同学进行下图实验,充分反应后,将试管①②内的物质倒入同一烧杯中混合,再次充分反应后过滤,结果得到滤渣A和无色滤液B。
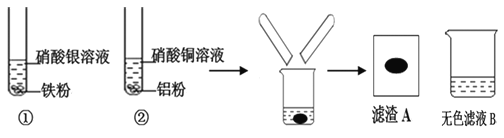
(1)试管①中反应的化学方程式为:_____________________ 。试管②中观察到的现象是:有红色固体析出,溶液________________。
(2)无色滤液B中含有的溶质为___________填化学式)
(3)设计实验探究滤渣A的成分
【提出问题】滤渣A的成分是什么?
【查阅资料】银、铜、铁、铝四种金属中,只有铝能与氢氧化钠溶液反应,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
【提出猜想】滤渣A的成分为:
猜想一:银、铜 猜想二:银、铜、铁 猜想三:银、铜、铁、______.
【分析思考】猜想一______(填“是”或“否”)合理,理由是__________________
【进行实验】区两份滤渣A样品进行以下实验,请填写下列空白。
样品 | 加入试剂 | 实验现象 |
第一份样品 | 足量稀盐酸 | 产生气泡,固体部分溶解,溶液变为___________ |
第二份样品 | 足量氢氧化钠溶液 | 现象b |
【做出判断】①如果现象b为“产生气泡,固体部分溶解”,则猜想_____成立;
②如果现象b为“______________________”,则猜想_____成立;
【答案】 Fe+2AgNO3=Fe (NO3)2+2Ag 由蓝色变无色 Al(NO3)3 铝 否 由无色滤液可知,铁已被置换出来 浅绿色 三 无明显现象 二
【解析】本题通过金属与盐溶液的反应考查了金属活动性顺序的运用。根据用同种金属置换不同的盐溶液,盐中金属排在金属活动性顺序中较后的金属首先被置换出来和盐溶液的颜色进行分析。
(1)试管①中的反应是硝酸银与铁反应生成硝酸亚铁和银,化学方程式为:Fe+2AgNO3=Fe (NO3)2+2Ag;试管②中的反应是硝酸铜与铝反应生成硝酸铝和铜,观察到的现象是:有红色固体析出,溶液由蓝色变无色;
(2) 滤液B呈无色,说明溶液中无硝酸亚铁(呈浅绿色)、硝酸铜(呈蓝色),滤液B中含有的溶质为硝酸铝,化学式为:Al(NO3)3;
(3) 提出猜想:反应过程中铝可能过量,所以猜想三:银、铜、铁、铝;
分析思考:猜想一不合理,由无色滤液可知,铁已被置换出来;
进行实验:由无色滤液可知,铁已被置换出来,加入盐酸时,铁与盐酸反应生成浅绿色的硫酸亚铁和氢气,实验现象是:产生气泡,固体部分溶解,溶液变为浅绿色;
做出判断:①银、铜、铁、铝四种金属中,只有铝能与氢氧化钠溶液反应放出氢气。如果现象b为“产生气泡,固体部分溶解”,固体中存在铝,则猜想三成立;②如果现象b为“无明显现象”,固体中没有铝,则猜想二成立。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案