题目内容
【题目】工业上用闪锌矿(主要含ZnS, 还含PbS等杂质)制备锌的流程如下(部分产物略去):

(1) X的化学式是________,图中用过量空气的目的是________。
(2)①~④中属于化合反应的是_________。
(3)写出反应③中生成ZnO的化学方程式________。
(4)结合下表数据设计:从粗锌中分离出纯锌的方案是__________。
物质 | Zn | Pb | C |
沸点°C | 907 | 1749 | 4827 |
【答案】CO2 使焦炭完全反应 ①② 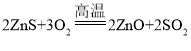 将粗锌置于907℃~1749℃的高温环境中,收集锌蒸气,冷却可得纯净的锌
将粗锌置于907℃~1749℃的高温环境中,收集锌蒸气,冷却可得纯净的锌
【解析】
(1)焦炭在氧气充足的条件下,在高温下反应生成二氧化碳,故X为二氧化碳,化学式为:CO2;
焦炭可与氧气在高温的条件下反应生成二氧化碳,用过量空气,可以使焦炭完全反应,故填:使焦炭完全反应;
(2)反应①为焦炭与氧气在高温的条件下反应生成二氧化碳,该反应的化学方程式为: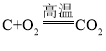 ,该反应符合“多变一”的特点,属于化合反应;
,该反应符合“多变一”的特点,属于化合反应;
反应②为焦炭与二氧化碳在高温的条件下反应生成一氧化碳,该反应的化学方程式为: 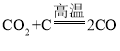 ,该反应符合“多变一”的特点,属于化合反应;
,该反应符合“多变一”的特点,属于化合反应;
反应③为闪锌矿中的ZnS在空气中煅烧生成二氧化硫和氧化锌,该反应的化学方程式为: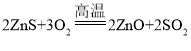 ,该反应不属于化合反应;
,该反应不属于化合反应;
反应④为氧化锌与一氧化碳在高温的条件下反应生成锌和二氧化碳,该反应的化学方程式为: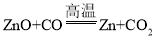 ,该反应符合“一种单质与一种化合物反应生成另一种单质和另一种化合物”的反应,属于置换反应。
,该反应符合“一种单质与一种化合物反应生成另一种单质和另一种化合物”的反应,属于置换反应。
故①~④中属于化合反应的是:①②;
(3)反应③为闪锌矿中的ZnS在空气中煅烧生成二氧化硫和氧化锌,该反应的化学方程式为: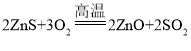 ;
;
(4)由表可知,Zn的沸点比Pb、C低,故可利用沸点的不同将它们分离,可将粗锌置于907℃~1749℃的高温环境中,收集锌蒸气,冷却可得纯净的锌,故填:将粗锌置于907℃~1749℃的高温环境中,收集锌蒸气,冷却可得纯净的锌。

 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案【题目】在一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如表所示。根据表中信息判断下列说法正确的是
物 质 | 甲 | 乙 | 丙 | 丁 |
反应前的质量 | 2 | 30 | 20 | 10 |
反应后的质量 | m | 39 | 5 | 16 |
A.该反应是化合反应B.甲一定是该反应的催化剂
C.反应过程中乙、丙变化的质量比为3:5D.丙可能是单质
【题目】在一密闭容器中发生某反应,其中甲、乙、丙、丁四种物质的质量变化如下表所示,下列判断正确的是______
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量(g) | 10 | 16 | 0 | 0 |
反应中质量(g) | M2 | 1.6 | ||
反应后质量(g) | M1 | 0 | 15.2 | 6.4 |
A M2的值是4
B甲、丁间反应的质量比为7 :8
C甲和乙是反应物
DM1的值是______