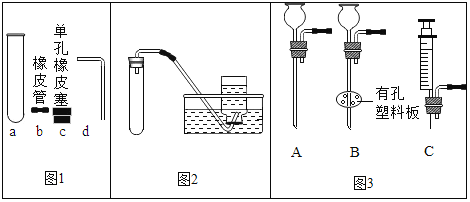
题目内容
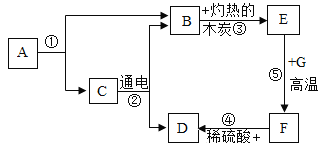
【题目】某矿山酸性废水(主要含硫酸、硫酸铁、硫酸铜和硫酸锌等),通过下述流程可将废水中的铁、铜和锌分步沉淀,实现回收利用。
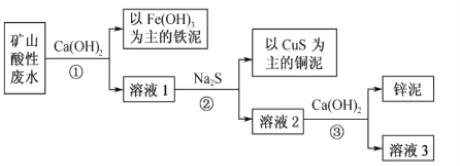
(1)步骤①中,加入Ca(OH)2有两个作用:
一是与废水中的硫酸发生反应,生成硫酸钙和水,则写出相应的化学方程式为:_____________。
二是将硫酸铁转化为Fe(OH)3。
(2)步骤①,得到铁泥的实验操作名称是___________,在该操作中将用到一种起引流作用的玻璃仪器,该仪器名称是___________。
(3)步骤②,生成的CuS中,S的化合价___________。
(4)对废水中的铁、铜和锌的重金属的回收,其意义是___________。
【答案】)Ca(OH)2+H2SO4=CaSO4+2H2O; 过滤 玻璃棒 ﹣2 有助于环保(合理即可)
【解析】
(1)氢氧化钙和硫酸反应生成硫酸钙和水,化学方程式为:Ca(OH)2+H2SO4=CaSO4+2H2O;
(2)过滤可以将不溶性固体从溶液中分离出来,所以步骤①得到铁泥的实验操作名称是过滤,在该操作中将用到一种起引流作用的玻璃仪器,该仪器名称是玻璃棒;
(3)化合价代数和为零,在CuS中,铜元素显+2价,所以S的化合价是﹣2;
(4)对废水中的铁、铜和锌的重金属的回收,意义是:有助于环保。

【题目】小明参观某养鱼池时,发现农民向养鱼池中撒一种叫做过氧化钙的淡黄色固体,用来增加鱼池中的含氧量。小明刚学完氧气的实验室制法,于是他想可否用过氧化钙制取氧气。
(提出问题)过氧化钙可否用于制取氧气?
(查阅资料)部分内容如下:过氧化钙(CaO2)室温下稳定,在300℃时分解成氧气,可做增氧剂、杀菌剂等。
(猜想与论证)
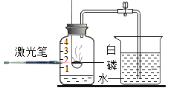
(1)小明依据_____,提出猜想Ⅰ。
(猜想Ⅰ)加热过氧化钙可制取氧气。
实验装置 | 实验主要过程 |
| ①检验装置气密性。操作如下:想将导管伸入液面下,用手紧握试管,观察到_____,松开后,有液体进入导管。 ②加入过氧化钙,加热,导管口有大量气泡冒出。 ③收集一瓶气体。 ④停止加热。熄灭酒精灯前,应_____。 ⑤检验气体。方法是_____。 |
(实验结论)加热过氧化钙可制取氧气。
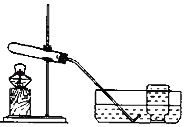
(2)小明联想到农民用过氧化钙增加鱼池中的含氧量,提出猜想Ⅱ。
(猜想Ⅱ)过氧化钙与水反应可制取氧气。
实验装置 | 实验主要过程 |
| ①检验装置气密性。 ②加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几乎看不到气体。该装置放置到第二天,集气瓶中只收集到极少量气体,震荡试管后仍有少量细小气泡缓慢放出。 |
(实验结论)不能用过氧化钙与水反应制取氧气,原因是_____。
(分析与反思)
①虽然没有快速收集到大量氧气,但由此实验现象,小明认为农民用过氧化钙做增氧剂的主要原因是_____。
②小明希望对此实验进行改进,使该反应加快,你能帮他提出建议吗?你的合理建议:_____。