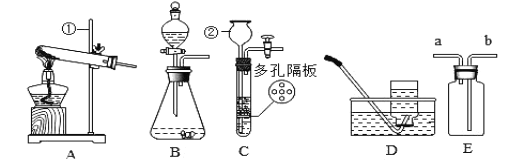
ΧβΡΩΡΎ»ί
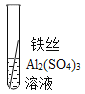
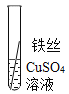
ΓΨΧβΡΩΓΩœρ Δ”–200gΝρΥαΆ≠»ή“ΚΒΡ…’±≠÷–Θ§÷πΒΈΦ”»κ÷ ΝΩΖ÷ ΐΈΣ8%ΒΡ«β―θΜ·ΡΤ»ή“ΚΘ§≤ζ…ζ≥ΝΒμΒΡ÷ ΝΩ”κΥυΒΈ»κ![]() »ή“Κ÷ ΝΩΒΡΙΊœΒ«ζœΏ»γΆΦΥυ ΨΘ§«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
»ή“Κ÷ ΝΩΒΡΙΊœΒ«ζœΏ»γΆΦΥυ ΨΘ§«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©Ζ¥”ΠΙΐ≥Χ÷–ΡήΩ¥ΒΫΒΡ“ΜœνΟςœ‘ΒΡœ÷œσ «______________ΓΘ
Θ®2Θ©…œ ωΖ¥”Π«ΓΚΟΆξ»Ϊ ±Θ§ΥυΒΟ»ή“Κ≥ _____________–‘Θ®ΧνΓΑΥαΓ±ΓΔΓΑΦνΓ±ΓΔΓΑ÷–Γ±÷°“ΜΘ©ΓΘ
Θ®3Θ©Β±Φ”»κ«β―θΜ·ΡΤ»ή“Κ÷ΝBΒψ ±Θ§»ή“Κ÷–ΒΡ»ή÷ ΈΣΘ®–¥Μ·―ß ΫΘ©_______ΓΘ
Θ®4Θ©Β±Φ”»κ«β―θΜ·ΡΤ»ή“Κ÷ΝAΒψ ±Θ§ ‘Ά®ΙΐΦΤΥψΘ§«σ¥Υ ±…’±≠÷–ΥυΒΟ≤Μ±ΞΚΆ»ή“ΚΒΡ÷ ΝΩ_______ΓΘΘ®ΦΤΥψΫαΙϊΨΪ»ΖΒΫ0.1gΘ©
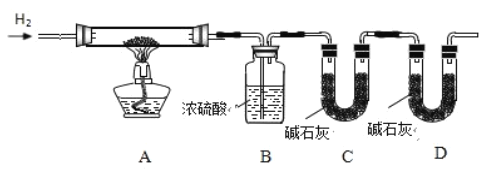
ΓΨ¥πΑΗΓΩ”–άΕ…Ϊ≥ΝΒμ…ζ≥…(Μρ»ή“Κ÷πΫΞ”…άΕ…Ϊ±δΈΣΈό…Ϊ) ÷– ![]()
![]()
ΓΨΫβΈωΓΩ
Θ®1Θ©Ζ¥”ΠΙΐ≥Χ÷–ΡήΩ¥ΒΫΒΡ“ΜœνΟςœ‘ΒΡœ÷œσ «άΕ…Ϊ≥ΝΒμ…ζ≥…(Μρ»ή“Κ÷πΫΞ”…άΕ…Ϊ±δΈΣΈό…Ϊ)ΘΜ
Θ®2Θ©ΝρΥαΆ≠”κ«β―θΜ·ΡΤΖ¥”Π…ζ‘ΎΝρΥαΡΤΚΆ«β―θΜ·Ά≠ΒΡ≥ΝΒμΘ§ΝρΥαΡΤ»ή“Κ≥ ÷––‘ΓΘ…œ ωΖ¥”Π«ΓΚΟΆξ»Ϊ ±Θ§ΥυΒΟ»ή“Κ≥ ÷––‘ΓΘ
Θ®3Θ©Β±Φ”»κ«β―θΜ·ΡΤ»ή“Κ÷ΝBΒψ ±Θ§«β―θΜ·ΡΤΙΐΝΩΘ§»ή“Κ÷–ΒΡ»ή÷ ΈΣNa2SO4ΓΔNaOHΓΘ
Θ®4Θ©≤ΈΦ”Ζ¥”ΠΒΡNaOHΒΡ÷ ΝΩΘΚ100gΓΝ8%ΘΫ8gΓΘ
…ηΖ¥”Π…ζ≥…CuΘ®OHΘ©2ΒΡ÷ ΝΩΈΣxΓΘ
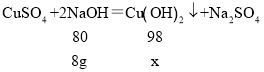
![]() Θ§ΫβΒΟxΘΫ9.8gΓΘ
Θ§ΫβΒΟxΘΫ9.8gΓΘ
200g+100g©¹9.8gΘΫ290.2gΓΘ
¥πΘΚ…’±≠÷–ΥυΒΟ≤Μ±ΞΚΆ»ή“ΚΒΡ÷ ΝΩΈΣ290.2gΓΘ

 ‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗΓΨΧβΡΩΓΩK2CO3ΚΆKNO3‘Ύ≤ΜΆ§Έ¬Ε» ±ΒΡ»ήΫβΕ»ΦΑΤδ»ήΫβΕ»«ζœΏ»γœ¬ΓΘœ¬Ν–ΥΒΖ®¥μΈσΒΡ «Θ® Θ©
Έ¬Ε»/Γφ | 20 | 30 | 50 | 60 | 80 | |
»ήΫβΕ»/g | K2CO3 | 110 | 114 | 121 | 126 | 139 |
KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 | |
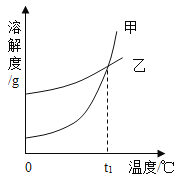
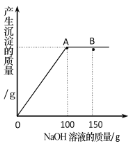
A.tΓφ‘Ύ60ΓφΒΫ80Γφ÷°Φδ
B.tΓφ ±Θ§ΝΫ÷÷»ή“ΚΒΡ»ή÷ ÷ ΝΩΖ÷ ΐ≤Μ“ΜΕ®œύΒ»
C.ΫΪ60Γφ ±ΒΡ210g KNO3±ΞΚΆ“ΚΫΒΈ¬÷Ν20ΓφΘ§ΡήΈω≥ωΨßΧε88.4g
D.ΝΫ÷÷±ΞΚΆ“Κ¥”80ΓφΫΒΈ¬ΒΫ20ΓφΘ§Έω≥ωΨßΧεΒΡ÷ ΝΩΘ®≤ΜΚ§ΫαΨßΥ°Θ©ΈόΖ®±»Ϋœ
ΓΨΧβΡΩΓΩΆΤάμ «―ßœΑΜ·―ßΒΡ“Μ÷÷÷Ί“ΣΖΫΖ®Θ§ΒΪ≤ΜΚœάμΒΡΆΤάμΜαΒΟ≥ω¥μΈσΒΡΫα¬έΘ°«κΕ‘œ¬Ν–¥μΈσΙέΒψ”ΟΜ·―ß ΫΜρΜ·―ßΖΫ≥Χ Ϋ–¥≥ωœύ”ΠΒΡΖώΕ®άΐ÷ΛΘ°
¥μΈσΙέΒψ | ΖώΕ®άΐ÷Λ | |
ΔΌ | ”–ΒΞ÷ ΚΆΜ·ΚœΈο…ζ≥…ΒΡΖ¥”Π“ΜΕ® «÷ΟΜΜΖ¥”Π | ΨΌάΐΘΚCuO+CO |
ΔΎ | Ψυ“ΜΓΔΈ»Ε®ΒΡ“ΚΧε“ΜΕ® «»ή“Κ | __ |
Δέ | Κ§”–ΧΦ‘ΣΥΊΒΡΜ·ΚœΈο“ΜΕ® «”–ΜζΈο | __ |
Δή | …ζ≥…―ΈΚΆΥ°ΒΡΖ¥”Π“ΜΕ® «÷–ΚΆΖ¥”Π | __ |
ΓΨΧβΡΩΓΩΧζΓΔ¬ΝΓΔΆ≠ «≥ΘΦϊΒΡ»ΐ÷÷Ϋπ τΓΘΆ§―ßΟ«ΖΔœ÷…ζΜν÷–ΒΡ¬ΝΚΆΆ≠÷ΤΤΖ±μΟφ“ΜΑψ≤Μ”ΟΖά–βΘ§ΕχΧζ÷ΤΤΖ“ΜΑψ–η“ΣΉωΖά–β¥ΠάμΓΘ
Θ®Χα≥ωΈ ΧβΘ©’β «≤Μ «“ρΈΣΧζΓΔ¬ΝΓΔΆ≠»ΐ÷÷Ϋπ τ÷–ΧζΒΡΜνΕ·–‘Ήν«ΩΡΊΘΩ
Θ® Β―ιΧΫΨΩΘ©Ά§―ßΟ«Ε‘»ΐ÷÷Ϋπ τΒΡΜνΕ·–‘Υ≥–ρ’ΙΩΣΝΥΧΫΨΩΘ§«κΡψ≤Έ”κΧΫΨΩ≤ΔΧν–¥Ω’ΗώΓΘΫΪ¥÷œΗœύΆ§ΒΡΧζΥΩΓΔ¬ΝΥΩΓΔΆ≠ΥΩΖ÷±π≤ε»κΧεΜΐœύΆ§»ή÷ ÷ ΝΩΖ÷ ΐ“≤œύΆ§ΒΡœΓ―ΈΥα÷–ΘΚ
≤ΌΉς |
|
|
| ΗυΨίœ÷œσΒΟ≥ωΫπ τΜνΕ·–‘Υ≥–ρ |
Τ§ΩΧΚσœ÷œσ | ”–…ΌΝΩΤχ≈ί | ΈόΤχ≈ί | ΈόΤχ≈ί |
|
ΦΗΖ÷÷”Κσœ÷œσ | ”–…ΌΝΩΤχ≈ί | ”–¥σΝΩΤχ≈ί | ΈόΤχ≈ί | _________________ |
Θ®Χ÷¬έΫΜΝςΘ©ΈΣ ≤Ο¥Ά§“ΜΗω Β―ιΒΟ≥ωΝΥΝΫ÷÷Ϋα¬έΡΊΘΩΆ§―ßΟ«¥χΉ≈’βΗω“…Έ ≤ι‘ΡΝΥœύΙΊΉ ΝœΘ§ΟςΑΉΝΥ¬ΝΥΩ‘ΎœΓ―ΈΥα÷–ΕΧ ±ΦδΡΎΈόΤχ≈ίΘ§ «“ρΈΣ¬Ν±μΟφ÷¬ΟήΒΡ―θΜ·ΡΛΜαœ»”κœΓ―ΈΥαΖ¥”ΠΓΘ
Θ®Ζ¥ΥΦΤάΦέΘ©ΉωΫπ τ–‘÷ Β―ι ±–ηΫΪΫπ τΫχ––¥ρΡΞΘ§¥ρΡΞΒΡΡΩΒΡ «_________________ΓΘ
Θ® Β―ι―ι÷ΛΘ©ΈΣΝΥΫχ“Μ≤Ϋ»Ζ»œΧζΓΔ¬ΝΓΔΆ≠’β»ΐ÷÷Ϋπ τΒΡΜνΕ·–‘Υ≥–ρΘ§Ά§―ßΟ«”÷ΫΪΝΫΗυ¥÷œΗœύΆ§ΒΡΓΔ¥ρΡΞΙΐΒΡΧζΥΩΖ÷±π≤ε»κΝρΥα¬Ν»ή“ΚΓΔΝρΥαΆ≠»ή“Κ÷–ΘΚ
≤ΌΉς |
|
| ΗυΨίœ÷œσΒΟ≥ω»ΐ÷÷Ϋπ τΜνΕ·–‘Υ≥–ρ |
œ÷œσ | ΈόΟςœ‘œ÷œσ | ___________________ |
|
–¥≥ωΧζ”κΝρΥαΆ≠»ή“ΚΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ___________________________ΓΘ
Θ®ΆΊ’Ι«®“ΤΘ©
Θ®1Θ©»τ÷Μ”–“Μ÷ß Δ”–…ΌΝΩœΓ―ΈΥαΒΡ ‘ΙήΘ§÷Μ–ηΚœάμΑ≤≈≈Ϋπ τΥΩΒΡ≤ε»κΥ≥–ρΘ®Ρή”κœΓ―ΈΥαΖ¥”ΠΒΡ“Σ“Μ¥ΈΫΪœΓ―ΈΥαœϊΚΡΆξΘ©Θ§“≤Ρή÷ΛΟςΧζΓΔ¬ΝΓΔΆ≠’β»ΐ÷÷Ϋπ τΒΡΜνΕ·–‘Υ≥–ρΓΘΫπ τΥΩΒΡ≤ε»κΥ≥–ρΈΣ_________ΓΘ
Θ®2Θ©Ϋπ τ±Μ»Υάύ¥σΙφΡΘΩΣΖΔάϊ”ΟΒΡ¥σ÷¬Ρξœό“≤”κΫπ τΜνΕ·–‘Υ≥–ρ”–ΙΊΘ§«κ–¥≥ωΧζΓΔ¬ΝΓΔΆ≠»ΐ÷÷Ϋπ τ≤ΡΝœ±Μ»Υάύάϊ”ΟΒΡœ»ΚσΥ≥–ρ___________________________ΓΘ