题目内容
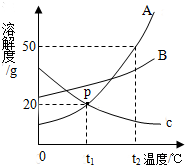 如图是a、b、c三种物质的溶解度曲线,a与c的溶解度 曲线相交于P点.据图回答:
如图是a、b、c三种物质的溶解度曲线,a与c的溶解度 曲线相交于P点.据图回答:(1)t2℃时30g a物质加入到50g水中不断搅拌,能形成溶液
(2)将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数大小关系是
A.c>a=b B.a=b>c C.a>b>c D.b>a>c
(3)若a中混有少量的b,提纯a的方法是
考点:固体溶解度曲线及其作用,结晶的原理、方法及其应用,溶质的质量分数、溶解性和溶解度的关系
专题:溶液、浊液与溶解度
分析:(1)根据t2℃时a物质的溶解度50g进行解答;
(2)根据饱和溶液溶质质量分数计算:
×100%,所以溶解度越大饱和溶液的溶质质量分数就越大,再根据升温后溶质和溶剂的量的变化考虑;
(3)根据两条曲线的走势即可.
(2)根据饱和溶液溶质质量分数计算:
| 溶解度 |
| 100g+溶解度 |
(3)根据两条曲线的走势即可.
解答:解:
(1)t2℃时a物质的溶解度50g,所以t2℃时30g的a物质加入到50g水中不断搅拌,只能溶解25ga物质,所以形成溶液的质量为75g;
(2)t1℃时三种物质的溶解度大小是:b>a═c;所以t1℃时三种物质的饱和溶液的溶质质量分数是:b>a═c,升温后a和b都变为不饱和溶液,所以溶质和溶剂都没减少,溶质质量分数不变;所以升温后溶质质量分数不变还是b>a,因为升温后c物质溶解度减小,析出晶体,所以c物质的溶质质量分数减小,所以升温后c物质的溶质质量分数小于a物质的溶质质量分数,所以b>a>c;
(3)从图象可以看出,A物质的溶解度随着温度的降低而降低,并且降低非常明显;B的溶解度虽然也随温度的降低而降低,但是降低非常小.因此对于A物质和B物质的混合溶液来说,随着温度的降低,A就会大量的析出.故:降温结晶即得较纯净的A物质.
答案:
(1)75
(2)D
(3)降温结晶
(1)t2℃时a物质的溶解度50g,所以t2℃时30g的a物质加入到50g水中不断搅拌,只能溶解25ga物质,所以形成溶液的质量为75g;
(2)t1℃时三种物质的溶解度大小是:b>a═c;所以t1℃时三种物质的饱和溶液的溶质质量分数是:b>a═c,升温后a和b都变为不饱和溶液,所以溶质和溶剂都没减少,溶质质量分数不变;所以升温后溶质质量分数不变还是b>a,因为升温后c物质溶解度减小,析出晶体,所以c物质的溶质质量分数减小,所以升温后c物质的溶质质量分数小于a物质的溶质质量分数,所以b>a>c;
(3)从图象可以看出,A物质的溶解度随着温度的降低而降低,并且降低非常明显;B的溶解度虽然也随温度的降低而降低,但是降低非常小.因此对于A物质和B物质的混合溶液来说,随着温度的降低,A就会大量的析出.故:降温结晶即得较纯净的A物质.
答案:
(1)75
(2)D
(3)降温结晶
点评:本题难度不大,主要考查了固体溶解度曲线的意义及根据固体溶解度曲线解决相应的问题,从而培养学生的理解能力和解决问题的能力.

练习册系列答案
相关题目
下列有关生理盐水(0.9%的氯化钠溶液)的说法,错误的是( )
| A、溶剂为氯化钠,溶质为水 |
| B、将一瓶生理盐水倒出一部分,剩下溶液中溶质的质量分数仍为0.9% |
| C、密封的生理盐水放置一段时间后,会有溶质析出 |
| D、向生理盐水中滴加硝酸银溶液,溶质氯化钠会与硝酸银反应生成沉淀 |
下列物质属于混合物的是( )
| A、清新的空气 | B、高锰酸钾 |
| C、冰水混合物 | D、碳酸钙 |
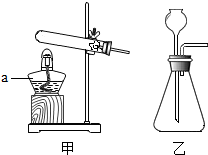 如图是实验室制取气体的装置.
如图是实验室制取气体的装置.

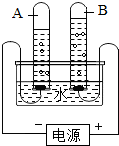 如图是电解水的实验装置图.分析回答问题.
如图是电解水的实验装置图.分析回答问题.