题目内容
为了检验久置的生石灰固体成分,现进行以下实验。
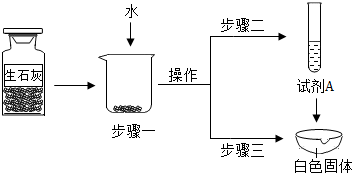
(1)步骤一:为了检验试剂瓶中氧化钙是否存在,依据氧化钙在水中是 (选填“放热”、“吸热”或“无热量变化”)的反应,采用温度计测量,整个实验过程中至少需要测定温度 次。初步结论:该样品中氧化钙存在。
(2)对步骤一烧杯中的混合物进行分离操作,该操作的名称是 。
(3)步骤二:测得溶液pH>7,能否证明样品中含有氢氧化钙,简述理由: 。
(4)步骤三:蒸发皿中加入试剂A是 ,蒸发皿中有气泡产生,白色固体中一定有的物质是 。用化学方程式表示生石灰变质成该物质的过程 。
(1)放热 ,2
(2)过滤
(3)不能,因为样品中氧化钙存在,它溶于水中生成氢氧化钙
(4)HCl ,CaCO3或碳酸钙 ,CaO+ H2O=Ca(OH)2 Ca(OH)2+CO2=CaCO3↓+H2O
【解析】
试题分析:(1)氧化钙与水反应生成氢氧化钙并放出热量;要检验试剂瓶中氧化钙是否存在,要测量溶解前的水温和溶解后液体的温度,故要测定温度2次;
(2)对固体和液体分离的方法是过滤;
(3)溶液pH>7 ,说明含有氢氧化钙,但因为样品中氧化钙存在,它溶于水中也会生成氢氧化钙,故不能证明样品中含有氢氧化钙;
(4)蒸发皿中有气泡产生,说明产生了气体,则加入的是稀盐酸,固体中有碳酸钙;生石灰变质成碳酸钙要发生两个反应:CaO+H2O==Ca(OH)2 Ca(OH)2+CO2==CaCO3↓+H2O
考点:氧化钙、氢氧化钙、碳酸钙的转化

为了检验久置的生石灰固体成分,现进行以下实验。
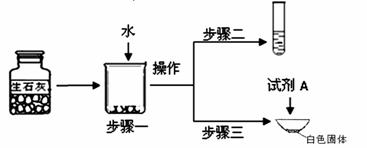 |
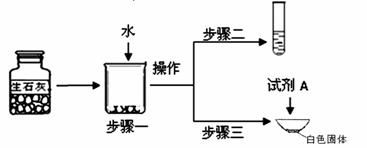
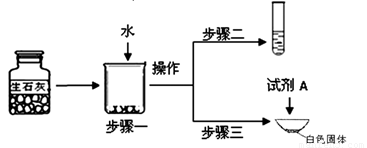
①步骤一:为了检验试剂瓶中氧 化钙是否存在,依据氧化钙在水中是 (6) (选填“放热”、“吸热”或“无热量变化”)的反应,采用温度计测量,整个实验过程中至少需要测定温度 (7) 次。初步结论:该样品中氧化钙存在。
化钙是否存在,依据氧化钙在水中是 (6) (选填“放热”、“吸热”或“无热量变化”)的反应,采用温度计测量,整个实验过程中至少需要测定温度 (7) 次。初步结论:该样品中氧化钙存在。
②对步骤一烧杯中的混合物进行分离操作,该操作的名称是 (8) 。
③步骤二:测得溶液pH>7,能否证明样品中含有氢氧化钙,简述理由: (9) 。
④步骤三:蒸发皿中加入试剂A是 (10) ,蒸发皿中有气泡产生,白色固体中一定有的物质是 (11) 。用化学方程式表示生石灰变质成该物质的过程 (12) 。