题目内容
为了检验久置的生石灰固体成分,现进行以下实验.
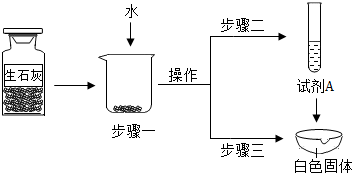
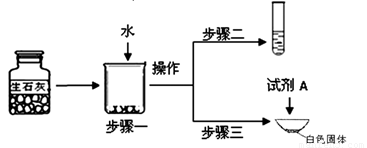
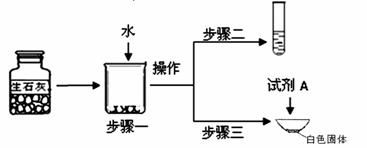
①步骤一:为了检验试剂瓶中氧化钙是否存在,依据氧化钙在水中是 (选填“放热”、“吸热”或“无热量变化”)的反应,采用温度计测量,整个实验过程中至少需要测定温度 次.初步结论:该样品中氧化钙存在.
②对步骤一烧杯中的混合物进行分离操作,该操作的名称是 .
③步骤二:测得溶液pH>7,能否证明样品中含有氢氧化钙,简述理由: .
④步骤三:蒸发皿中加入试剂A是 ,蒸发皿中有气泡产生,白色固体中一定有的物质是 .用化学方程式表示生石灰变质成该物质的过程 .

①步骤一:为了检验试剂瓶中氧化钙是否存在,依据氧化钙在水中是
②对步骤一烧杯中的混合物进行分离操作,该操作的名称是
③步骤二:测得溶液pH>7,能否证明样品中含有氢氧化钙,简述理由:
④步骤三:蒸发皿中加入试剂A是
分析:①根据氧化钙和水反应放热进行解答;
②根据过滤用于分离难溶性和可溶性固体进行解答;
③根据样品中氧化钙存在,它溶于水中生成氢氧化钙进行解答;
④根据盐酸和碳酸钙反应生成二氧化碳气体以及二氧化碳和氢氧化钙反应生成碳酸钙和水进行解答.
②根据过滤用于分离难溶性和可溶性固体进行解答;
③根据样品中氧化钙存在,它溶于水中生成氢氧化钙进行解答;
④根据盐酸和碳酸钙反应生成二氧化碳气体以及二氧化碳和氢氧化钙反应生成碳酸钙和水进行解答.
解答:解:①氧化钙和水反应放热,所以采用温度计测量,整个实验过程中至少需要测定温度2次.初步结论:该样品中氧化钙存在;
②过滤用于分离难溶性和可溶性固体,所以对步骤一烧杯中的混合物进行分离操作,该操作的名称是过滤;
③样品中氧化钙存在,它溶于水中生成氢氧化钙,所以测得溶液pH>7,不能证明样品中含有氢氧化钙;
④盐酸和碳酸钙反应生成二氧化碳气体,所以蒸发皿中加入试剂A是稀盐酸;氧化钙和水反应生成氢氧化钙,二氧化碳和氢氧化钙反应生成碳酸钙和水,化学方程式为CaO+H2O═Ca(OH)2、Ca(OH)2+CO2═CaCO3↓+H2O.
故答案为:①放热;2;
②过滤;
③不能,因为样品中氧化钙存在,它溶于水中生成氢氧化钙;
④HCl;CaCO3;CaO+H2O═Ca(OH)2、Ca(OH)2+CO2═CaCO3↓+H2O.
②过滤用于分离难溶性和可溶性固体,所以对步骤一烧杯中的混合物进行分离操作,该操作的名称是过滤;
③样品中氧化钙存在,它溶于水中生成氢氧化钙,所以测得溶液pH>7,不能证明样品中含有氢氧化钙;
④盐酸和碳酸钙反应生成二氧化碳气体,所以蒸发皿中加入试剂A是稀盐酸;氧化钙和水反应生成氢氧化钙,二氧化碳和氢氧化钙反应生成碳酸钙和水,化学方程式为CaO+H2O═Ca(OH)2、Ca(OH)2+CO2═CaCO3↓+H2O.
故答案为:①放热;2;
②过滤;
③不能,因为样品中氧化钙存在,它溶于水中生成氢氧化钙;
④HCl;CaCO3;CaO+H2O═Ca(OH)2、Ca(OH)2+CO2═CaCO3↓+H2O.
点评:化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,有助于提高观察实验、进行实验的能力.所以,对化学实验不仅要认真观察,还应掌握设计实验、观察实验现象的方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
为了检验久置的生石灰固体成分,现进行以下实验。
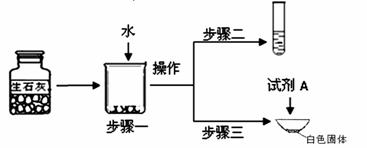 |
①步骤一:为了检验试剂瓶中氧 化钙是否存在,依据氧化钙在水中是 (6) (选填“放热”、“吸热”或“无热量变化”)的反应,采用温度计测量,整个实验过程中至少需要测定温度 (7) 次。初步结论:该样品中氧化钙存在。
化钙是否存在,依据氧化钙在水中是 (6) (选填“放热”、“吸热”或“无热量变化”)的反应,采用温度计测量,整个实验过程中至少需要测定温度 (7) 次。初步结论:该样品中氧化钙存在。
②对步骤一烧杯中的混合物进行分离操作,该操作的名称是 (8) 。
③步骤二:测得溶液pH>7,能否证明样品中含有氢氧化钙,简述理由: (9) 。
④步骤三:蒸发皿中加入试剂A是 (10) ,蒸发皿中有气泡产生,白色固体中一定有的物质是 (11) 。用化学方程式表示生石灰变质成该物质的过程 (12) 。