题目内容
【题目】在高温下,铁与水蒸气能发生反应生成一种常见的铁的氧化物和一种气体.某兴趣小组请你参与研究:铁与水蒸气反应一段时间后剩余固体物质的成分、性质及再利用.
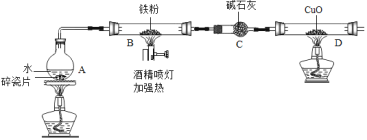
(1)【推断】观察到D中黑色固体变红,则B中生成的气体是 (2)探究B装置中剩余固体成分是什么?
【查阅资料】
1.碎瓦片能防爆沸,碱石灰是氧化钙和氢氧化钠的混合物
2.铁的氧化物中,只有Fe2O3是红棕色,其余均为黑色,只有Fe3O4能被磁铁吸引.
【初步探究】B装置中剩余固体为黑色,能全部被磁铁吸引
【猜想与假设】
猜想一:剩余固体是Fe3O4
猜想二:剩余固体是
【实验探究】
实验操作 | 实验现象及结论 |
【实验结论】铁与水蒸气反应的化学方程式为
(3)【成分再利用】若将B装置中剩余的黑色固体ag,经过一系列转化,全部变为红棕色固体Fe2O3(假设转化过程中铁元素无损耗),增加的质量为x,则x的取值范围为 .
【答案】(1)氢气
【猜想与假设】Fe和Fe3O4的化合物
【实验探究】取少量黑色固体,加入足量稀盐酸 无气泡产生,黑色固体是Fe3O4
【实验结论】3Fe+ 4H2O高温Fe3O4+ 4H2
(3)0.03a≤x<0.43a
【解析】
试题分析:(1)根据D中黑色固体变红,说明气体B具有还原性,结合质量守恒定律,化学反应前后,元素的种类不变,故可判断B中生成的气体是氢气
【猜想与假设】根据资料以及初步探究的现象,故猜想二:剩余固体是Fe和Fe3O4的化合物
【实验探究】根据金属单质铁的化学性质:能与酸反应产生氢气,故实验操作步骤:取少量黑色固体,加入足量稀盐酸;实验现象及结论:无气泡产生,黑色固体是Fe3O4
【实验结论】铁与水蒸气反应的化学方程式为:3Fe+4H2O高温Fe3O4+4H2
(3)采用极值的处理方法,1、假设黑色固体全部为单质铁,设变为红棕色固体Fe2O3为b,则可列式为:a=b×112/180×100%,可计算出b=1.43a,故增加的质量为x=1.43a-a=0.43a;2、假设黑色固体全部为Fe3O4,同样设变为红棕色固体Fe2O3为b,则可列式为:a×168/232×100%=b×112/180×100%,可计算出b=1.03a,故增加的质量为x=1.03a-a=0.03a;故x的取值范围为:0.03a≤x<0.43a

【题目】以下是我国颁布的有关空气污染指数与质量级别、质量状况的分级标准:
污染指数 | 50以下 | 51—100 | 101—200 | 201—250 | 251—300 | 300以上 |
质量级别 | Ⅰ | Ⅱ | Ⅲ | Ⅳ(1) | Ⅳ(2) | Ⅴ |
质量状况 | 好 | 良好 | 轻度污染 | 中度污染 | 中度重污染 | 重度污染 |
某市2005年6月8日的空气污染指数为56—76。根据以上信息判断该市当天的空气质量级别和空气质量状况分别是
A、Ⅰ级 好 B、Ⅱ 良好 C、Ⅲ 轻度污染 D、Ⅴ 重度污染

