题目内容
【题目】某学习小组准备探究气体的测定和数据处理方法。
【提出问题】利用碳酸钙与稀盐酸反应来测定生成CO2的量。
【实验设计】通过下列两个实验分别测定CO2的质量和体积。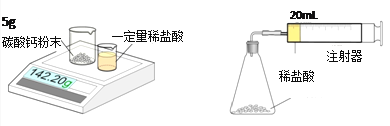
实验一 实验二
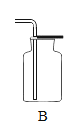
(1)【分析处理】实验一:
① 将小烧杯中的稀盐酸分几次加入到大烧杯中,并不断搅拌,判断反应后盐酸过量的依据是。
②若稀盐酸足量,计算理论上能产生二氧化碳的物质的量。(根据化学方程式进行计算)
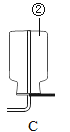
实验二:
③ 先连接好装置,再(填操作),然后装好药品,最后将20mL稀盐酸快速推入锥形瓶中。若缓慢推入,则可能造成的后果是。
④ 实验记录如下(表中数据在相同温度、相同压强条件下测定):
时间/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
注射器读数/mL | 60.0 | 85.0 | 88.0 | 89.0 | 89.5 | 89.8 | 89.9 | 90.0 | 90.0 | 90.0 |
根据以上实验过程和数据综合分析,最终生成CO2的体积是mL。
(2)【反思与评价】经过分析,下列说法错误的是。
A.实验一的操作简单,便于读数
B.实验一最终得到的数据和通过计算得出的理论值完全相等
C.实验二在密闭体系内反应,更环保
D.实验二中若将碳酸钙粉末改成块状的大理石,更安全
【答案】
(1)最后一次加入稀盐酸后,电子天平上的示数不再发生变化(或“不再减小”或“没有气泡产生”);0.05mol;检查装置气密性;锥形瓶内产生大量气体,压强变大,导致盐酸无法推入;70
(2)B
【解析】①碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,当没有气泡产生时说明反应已经完全;
②根据碳酸钙的质量,利用反应的化学方程式可计算出生成的二氧化碳的质量;
n(CaCO3)=5/100=0.05mol
设产生的二氧化碳为xmol
CaCO3+2HCl→CaCl2+ H2O+CO2↑
1 1
0.05 x
1/0.05 = 1/x
x=0.05mol
答:产生的二氧化碳为0.05mol;
③连接好装置后要先检查装置的气密性;碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,生成了气体会导致锥形瓶内的压强变大,故若缓慢推入会导致盐酸无法推入;
④由图可知注射器中的开始示数为20ml,最终示数为90ml,故生成的二氧化碳的体积为70ml;
⑤由于二氧化碳易溶于水,生成了二氧化碳部分会溶解在水中。
【考点精析】掌握根据化学反应方程式的计算是解答本题的根本,需要知道各物质间质量比=系数×相对分子质量之比.