题目内容
【题目】铜跟稀硝酸可发生反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。现有4.8g的铜与100g的稀硝酸恰好完全反应。
(1)根据化学方程式计算反应生成的一氧化氮质量为多少__________?
(2)求反应后溶液的溶质质量分数___________。
【答案】 1.5g, 13.6%。
【解析】利用化学方程式,根据一氧化氮和铜反应的质量比即可计算出生成的一氧化氮的质量。反应后所得的溶液是硝酸铜溶液,溶质硝酸铜的质量可利用化学方程式计算出,溶液的质量可采用质量守恒法计算。
设生成的一氧化氮质量为x,生成的硝酸铜的质量为y;
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
192 564 60
4.8g y x
![]() x=1.5g
x=1.5g
![]() y=14.1g
y=14.1g
反应后溶液的质量=4.8g+100g-1.5g=103.3g
反应后溶液的溶质质量分数=![]()
![]()
![]() =13.6%
=13.6%
答:生成的一氧化氮质量为1.5g;反应后溶液的溶质质量分数13.6%。

练习册系列答案
相关题目
【题目】下列实验目的、操作、现象、结论都正确的是
选项 | 实验目的 | 实验操作 | 实验现象 | 实验结论 |
A | 测溶液pH | 用玻璃棒蘸取待测液滴在用蒸馏水润湿的pH试纸上 | 试纸变为浅红色 | 溶液pH为2 |
B | 鉴别NaOH和NH4NO3 | 在装有等量水的试管中分别加入a、b固体 | 加a的试管水温升高,加b的试管水温降低 | a是NaOH b是NH4NO3 |
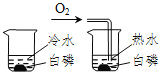
C | 验证燃烧是否需要O2 |
| 前者不燃烧,后者燃烧 | 燃烧需要O2 |
D | 比较Al、Cu的活泼性 | 将未经打磨的Al条放入CuSO4溶液中 | 无明显现象 | 活泼性Al<Cu |
A. A B. B C. C D. D