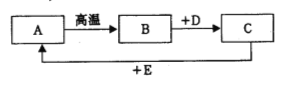
题目内容
【题目】某实验小组利用废硫酸液制备K2SO4 主要过程如下:

(1)反应Ⅰ过程中要不断搅拌,其目的是__________________________________。
(2)上述流程中可循环使用的物质有CO2和_______________(填写名称)。
(3)反应Ⅲ中相关物质的溶解度如下表。你认为反应Ⅲ在常温下能实现的原因是_____________。
物质 | KCl | K2SO4 | NH4Cl | M |
溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
请写出该反应的化学方程式 ______________________。
(4)将反应Ⅲ得到的K2SO4晶体用饱和K 2SO4溶液洗涤而不用水洗的目的是_____________。
【答案】 让反应物混合均匀,充分反应 碳酸钙 常温下K2SO4的溶解度小 2KCl +(NH4)2SO4= K2SO4↓+2NH4Cl 减少K2SO4晶体在洗涤时的损耗
【解析】(1)反应1 是碳酸钙与稀硫酸反应,过程中不断的搅拌,目的是让碳酸钙与稀硫酸成分接触,成分反应;
(2)由图可知该过程中二氧化碳和碳酸钙可以重复使用;
(3)常温下硫酸钾的溶解度较小,故氯化钾可以和碳酸铵反应生成硫酸钾和氯化铵,反应方程式为2KCl +(NH4)2SO4= K2SO4↓+2NH4Cl;为了减少K2SO4晶体在洗涤时的损耗,故用饱和硫酸钾溶液洗涤硫酸钾晶体;

【题目】实验室需配置一定浓度的硝酸钾溶液。
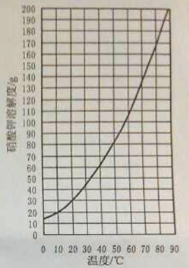
(1) 查阅硝酸钾溶解性。由右图可知,20℃时,硝酸钾的溶解度为 g,在该温度下配制硝酸钾溶液,溶质质量分数最大为 %(计算结果保留整数)。
(2)计算。配置40g质量分数为10%的硝酸钾溶液,所需硝酸钾质量为 g,所需蒸馏水的体积为 mL(水的密度近似看做1g/mL)。
(3)称量。分别在天平左右两盘放上纸片,调节平衡后, (填字母)。
A、先移动游码到所需位置,再添加硝酸钾直到天平平衡
B、先添加所需的硝酸钾,再移动游码直到天平平衡
(4)量取。量取所需蒸馏水要用到的仪器是 (填字母)。

(5)溶解。将称量好的硝酸钾和蒸馏水混合溶解。
(6)稀释。20℃时,将20mL质量分数为10%的硝酸钾溶液,稀释成质量分数为4%的硝酸钾溶液。从下表中找出需要用到的数据: g/mL。
硝酸钾溶液的密度(单位1g/mL)
质量分数/% | 20 | 40 | 60 |
4 | 1.023 | 1.016 | 1.007 |
10 | 1.063 | 1.054 | 1.044 |
【题目】氢氧化钠、碳酸钠分别在水、酒精中的溶解度如表所示,请结合图表数据回答下列问题:
氢氧化钠 | 碳酸钠 | |||
20℃ | 40℃ | 20℃ | 40℃ | |
水 | 109g | 129g | 21.8g | 49g |
酒精 | 17.3g | 40g | 不溶 | 不溶 |
(1)下图表示________(填“氢氧化钠”或“碳酸钠”)的溶解度曲线。

(2)温度从20℃升到40℃时,氢氧化钠在水中的溶解度变化__________(填“大于”或“小于”)碳酸钠在水中的溶解度变化。
(3)40℃ 时,若将50gNaOH分别投入到100g水和100g酒精中,能形成饱和溶液的溶剂是__,再将CO2通入所得NaOH的酒精溶液中,观察到的现象为______________。
(4)若要对比两种固体物质的溶解性,必须在_____________、______________ 、_____________的条件下进行对比。
【题目】如图是一套检验气体性质的实验装置,向装置中持续通入气体X,若打开活塞K,只观察到紫色石蕊变红;若关闭活塞K,可观察到紫色石蕊试液变红,澄清石灰水变浑浊。据此判断气体X和洗瓶内的液体Y可能是( )

A | B | C | D | |
X | 二氧化碳 | 氯化氢 | 二氧化碳 | 氯化氢 |
Y(足量) | 水 | 碳酸钠溶液 | 氢氧化钠溶液 | 氢氧化钠溶液 |
A. A B. B C. C D. D