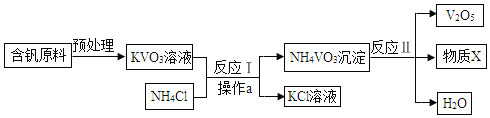
题目内容
【题目】将一定量的锌粉加入![]() 和
和![]() 的混合液中,充分反应后过滤,得到蓝色滤液和滤渣,下列有关分析错误的是
的混合液中,充分反应后过滤,得到蓝色滤液和滤渣,下列有关分析错误的是![]()
A. 滤液中一定有入![]() 和
和![]()
B. 滤渣中一定有Ag和Cu
C. 滤液中可能含有![]()
D. 可加入HCl确定滤液成分
【答案】B
【解析】将一定量的锌粉加入硝酸铜和硝酸银的混合液中,充分反应后过滤,得到蓝色滤液和滤渣,锌比铜活泼,铜比银活泼,锌可以置换出铜和银,铜可以置换出银,蓝色滤液是硝酸铜,说明锌是不过量。A、滤液中一定有入硝酸铜和硝酸锌,故A正确;B、滤渣中一定有Ag,不一定有Cu,故B错误;C、滤液中可能含有硝酸银,故C正确;D、可加入HCl确定滤液成分,盐酸与硝酸银反应生成氯化银白色沉淀,故D正确。
点睛∶锌比铜活泼,铜比银活泼,锌可以置换出硝酸铜和硝酸银中的铜和银,铜可以置换出硝酸银中的银,硝酸铜是蓝色滤液。

 阅读快车系列答案
阅读快车系列答案【题目】同学们对制作糕点常用膨松剂Na2CO3或NaHCO3进行了下列探究。
【查阅资料】
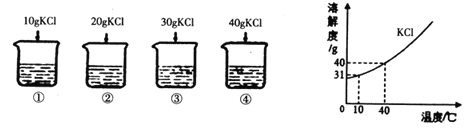
溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
【探究一】NaHCO3和Na2CO3性质差异的探究
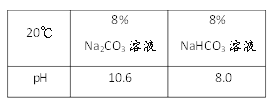
(1)现有20℃时溶质质量分数为8%的Na2CO3和NaHCO3溶液酸碱性:取样于试管中,分别滴加紫色石蕊试液,均显_____色;酸碱度:NaHCO3溶液________Na2CO3溶液(填“>”或”“<”)。
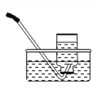
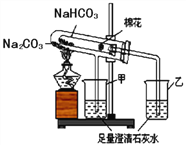
(2)稳定性:按下图,实验中可观察乙烧杯中的石灰水变浑浊,甲烧杯不变,则乙烧杯中发生反应的化学方程式为:___________________________。结论:在受热条件下,碳酸钠比碳酸氢钠稳定性______(填“强”或“弱”)。
(3)利用溶解度鉴别NaHCO3和Na2CO3:分别取Xg两种固体粉末加入20℃,10g水中充分溶解,通过观察溶解现象来区分,X可以是下列的_______。(选填A、B或C)
A.1.5g B.0.96g C.0.5g
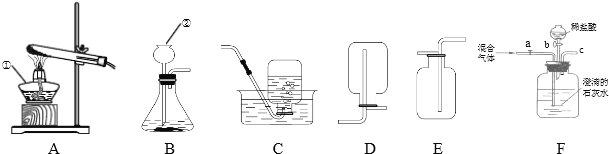
【探究二】测定NaHCO3和Na2CO3混合物10.0g中NaHCO3的质量分数(下图,夹持装置略)
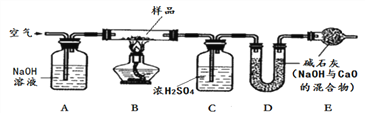
【问题讨论】
(4)实验前先通一段时间的空气的目的是____________________;
(5)A的作用是_____________________________,若没有装置E,NaHCO3的质量分数测定结果会_____________(填“偏大”、“不变”或“偏小”)。
(6)停止加热后,仍继续通入空气一段时间,目的是___________________。
【含量测定】
(7)测得装置D的质量实验前为120.2g,实验后为122.4g,计算该样品中NaHCO3的质量分数。(要有计算过程)______________________
【知识拓展】
(8)向饱和的氯化钠溶液中通入氨气和二氧化碳,经过一系列变化,也可制得Na2CO3和一种铵盐。该反应的化学反应方程式为:_______________________。