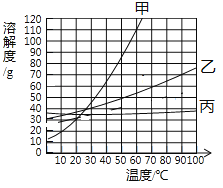
题目内容
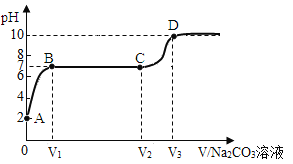
【题目】某纯碱样品中含有少量氯化钠,取该样品11g,全部溶液在100g水中,再逐渐滴加氯化钙溶液,反应的情况如图所示,A点时,过滤,得到滤液242g,计算:
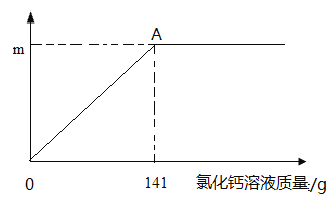
(1)反应生成沉淀的质量m为 g。
(2)滤液中溶质的质量分数。
【答案】(1)10 (2)5%
【解析】
试题分析:(1)根据题意,发生的化学反应方程式为:CaCl2+Na2CO3==CaCO3↓+2NaCl,反应生成沉淀CaCO3,再根据反应前各物质的质量和与反应后所得溶液的质量差,即为反应过程中生成的CaCO3质量,故反应生成沉淀的质量m=11g+100g+141g-242g=10g
(2)根据反应方程式:CaCl2+Na2CO3==CaCO3↓+2NaCl中CaCO3与Na2CO3、NaCl的质量关系,可分别计算出原纯碱样品中Na2CO3的质量,以及生成的NaCl的质量,进一步计算滤液中溶质的质量分数
解:设Na2CO3的质量为x,生成的NaCl的质量为y
CaCl2+Na2CO3==CaCO3↓+2NaCl
106 100 117
x 10g y
106:100=x:10g x=10.6g
117:100=y:10g y=11.7g
故溶液中溶质NaCl的质量=11g-10.6g+11.7g=12.1g
所以滤液中溶质的质量分数=12.1g/242g×100%=5%

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目