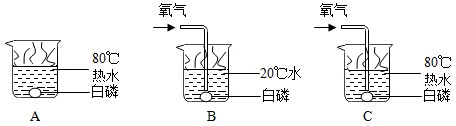
题目内容
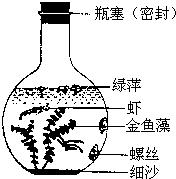 17、下图所示,是某校研究性学习小组模拟池塘生态系统制作的一个封闭生态瓶(瓶中生物生长良好),请据图回答:
17、下图所示,是某校研究性学习小组模拟池塘生态系统制作的一个封闭生态瓶(瓶中生物生长良好),请据图回答:(1)该生态瓶中属于生产者的是
金鱼藻、绿萍
.(2)该生态瓶放置在明亮的窗台上(天气晴朗并不采用其他光源),那么生态瓶中早晨水溶液的pH
<
(填“<7”“=7”或“>7”),傍晚时水溶液的pH=7
(填“<7”“=7”或“>7”);理由是早晨水中因溶解二氧化碳而含有碳酸,傍晚时水中不含二氧化碳
.分析:(1)绿色植物在生态系统中作为第一营养级属于生产者;
(2)经过夜晚的呼吸作用,水中溶解有较多的二氧化碳;经过一天的光合作用,水中的二氧化碳全部被消耗;二氧化碳溶解于水可形成碳酸,溶液pH小于7.
(2)经过夜晚的呼吸作用,水中溶解有较多的二氧化碳;经过一天的光合作用,水中的二氧化碳全部被消耗;二氧化碳溶解于水可形成碳酸,溶液pH小于7.
解答:解:
(1)绿色植物金鱼藻、绿萍中的叶绿体进行光合作用产生有机物释放氧气,同时可为生态系统中的动物提供营养物质.
(2)夜晚无光情况下,金鱼藻、绿萍等的呼吸作用产生的二氧化碳溶解在水中,此时水中含有一定量的碳酸,生态瓶中早晨水溶液的pH小于7;经过一白天的光合作用,傍晚时水中不含二氧化碳,此时水溶液的pH又恢复至中性,即等于7;
故答案为:(1)金鱼藻、绿萍;(2)<;=;早晨水中因溶解二氧化碳而含有碳酸,傍晚时水中不含二氧化碳.
(1)绿色植物金鱼藻、绿萍中的叶绿体进行光合作用产生有机物释放氧气,同时可为生态系统中的动物提供营养物质.
(2)夜晚无光情况下,金鱼藻、绿萍等的呼吸作用产生的二氧化碳溶解在水中,此时水中含有一定量的碳酸,生态瓶中早晨水溶液的pH小于7;经过一白天的光合作用,傍晚时水中不含二氧化碳,此时水溶液的pH又恢复至中性,即等于7;
故答案为:(1)金鱼藻、绿萍;(2)<;=;早晨水中因溶解二氧化碳而含有碳酸,傍晚时水中不含二氧化碳.
点评:此题属于化学与生物学结合的跨学科题型,其中光合与呼吸作用的知识使得两个学科相结合,对于光合与呼吸作用的理解是解决好此题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.
[查阅资料]
<资料1>该厂采用“侯氏制碱法”生产的化工产品为纯碱(化学式为 )和氯化铵.
(“侯氏制碱法”是我国近代著名科学家侯德榜发明的一种连续生产纯碱与氯化铵的联合制碱工艺.)
<资料2>生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
<资料3>部分生产流程如下图所示.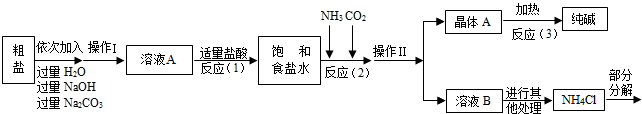
上述流程中涉及的部分反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
Na2CO3+CaCl2=CaCO3↓+2NaCl;NH4Cl═NH3↑+HCl↑
生产原理:将氨气(NH3)和二氧化碳通入饱和食盐水中得到小苏打和氯化铵的混合物,其反应的化学方程式为:NaCl(饱和溶液)+NH3+CO2+H2O=NaHCO3(晶体)↓+NH4Cl;分离出NaHCO3,使其充分受热即可分解制得纯碱及两种常见的氧化物,此反应的化学方程式为 .
【问题讨论】
(1)溶液A中的溶质为 ,操作Ⅱ的名称为 .
(2)上述生产流程中可循环使用的是 (填序号).
A.CO2B.NH3C.HCl D.NaOH E.Na2CO3
(3)根据上述信息,请你设计实验区分碳酸钠和碳酸氢钠.
【含量测定】
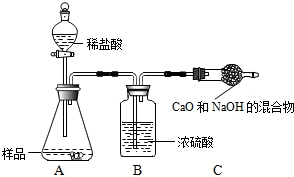
同学们为了测定该纯碱样品的纯度,设计了如下实验.
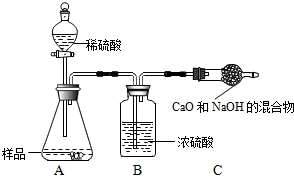
甲组:取10.0g纯碱样品(假定杂质在整个实验过程中不发生变化),向其中加入过量的盐酸,直至样品中无气泡冒出.充分加热蒸发所得物质并干燥、冷却至室温后称量,所得固体质量为10.9g.样品中碳酸钠的质量分数为 (结果保留一位小数).
乙组:取10.0g纯碱样品,利用右图所示装置,测出反应后装置C增重了3.5g(所加试剂均足量).
实验结束后,发现乙组测定的质量分数偏小,其原因是 .
[查阅资料]
<资料1>该厂采用“侯氏制碱法”生产的化工产品为纯碱(化学式为
(“侯氏制碱法”是我国近代著名科学家侯德榜发明的一种连续生产纯碱与氯化铵的联合制碱工艺.)
<资料2>生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
<资料3>部分生产流程如下图所示.

上述流程中涉及的部分反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
Na2CO3+CaCl2=CaCO3↓+2NaCl;NH4Cl═NH3↑+HCl↑
生产原理:将氨气(NH3)和二氧化碳通入饱和食盐水中得到小苏打和氯化铵的混合物,其反应的化学方程式为:NaCl(饱和溶液)+NH3+CO2+H2O=NaHCO3(晶体)↓+NH4Cl;分离出NaHCO3,使其充分受热即可分解制得纯碱及两种常见的氧化物,此反应的化学方程式为
【问题讨论】
(1)溶液A中的溶质为
(2)上述生产流程中可循环使用的是
A.CO2B.NH3C.HCl D.NaOH E.Na2CO3
(3)根据上述信息,请你设计实验区分碳酸钠和碳酸氢钠.
| 实验步骤 | 实验现象 | 实验结论 |
同学们为了测定该纯碱样品的纯度,设计了如下实验.

甲组:取10.0g纯碱样品(假定杂质在整个实验过程中不发生变化),向其中加入过量的盐酸,直至样品中无气泡冒出.充分加热蒸发所得物质并干燥、冷却至室温后称量,所得固体质量为10.9g.样品中碳酸钠的质量分数为
乙组:取10.0g纯碱样品,利用右图所示装置,测出反应后装置C增重了3.5g(所加试剂均足量).
实验结束后,发现乙组测定的质量分数偏小,其原因是