题目内容
【题目】为测定某铜锌合金中锌的含量,取50g样品进行实验,将l00g稀盐酸分五次加入该样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如表所示:
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
生成气体的总质量/g | 0.05 | 0.10 | m | 0.20 | 0.20 |
试求:(1)m的数值为______
(2)该铜锌合金中锌的质量分数是________?(写出计算过程)
【答案】0.20 13%
【解析】
(1)根据分五次加入盐酸后,前两次,每次都增加0.05g氢气,第四、五都生成0.20g氢气,说明第三次没有完全反应,也增加0.05g进行分析;
(2)根据锌和盐酸反应的化学方程式和生成氢气的质量计算锌的质量,然后计算锌的质量分数。
解:(1)根据表中数据,前两次,每次都增加0.05g氢气,第四、五都生成0.20g氢气,说明第三次没有完全反应,也增加0.05g,所以m值是0.15;
(2)设合金中锌的质量为x,
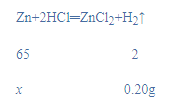
![]()
x=6.5g;
铜锌合金中锌的质量分数是![]() ×100%=13%;
×100%=13%;
答:该铜锌合金中锌质量分数是13%。

【题目】某化学兴趣小组的同学们对木炭和氧化铜在高温条件下反应实验进行了探究。
[提出问题]生成的气体产物的成分是什么呢?
[作出猜想]猜想1.二氧化碳;猜想2.一氧化碳;猜想3.________________。
[设计实验]
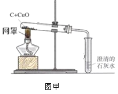
实验一.同学们设计如图甲所示装置进行实验,甲、乙同学根据实验现象得出结论如下:
实验现象 | 实验结论 | |
甲 | 澄清的石灰水变浑浊 | 猜想1正确 |
乙 | 澄清的石灰水不变浑浊 | 猜想2正确 |
(1)同学们对甲、乙同学由现象得出的结论进行了分析和评价,其中由现象得出的结论不科学的是________(填“甲”或“乙”)。
实验二.同学们讨论后,又设计了如图乙所示的装置进行实验。
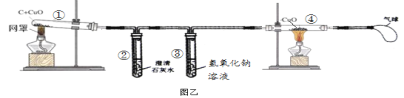
(2)能证明猜想3正确的的现象是_________________和____________________。
(3)实验后发现试管②内壁上附着不易用试管刷洗净的固体生成物,清洗试管②的
方法是_______________________。