题目内容
【题目】某中学实验探究小组的同学进行了下列四个实验:
A 向Ca(OH)2溶液中通入少量的CO2
B 向Ca(OH)2溶液中滴加酚酞溶液
C 向Ca(OH)2溶液中滴如稀盐酸
D 向Ca(OH)2溶液中滴CaCl2溶液
请回答下列问题:
(1)提出问题:该小组探究的问题是碱的_________性质。
(2)交流与讨论:
①实验A中观察到的现象是________、反应的化学方程式为________。
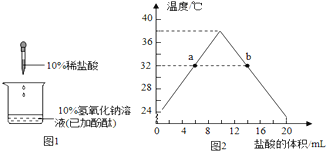
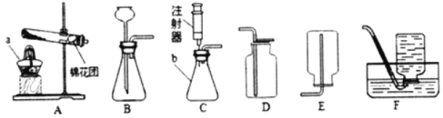
②实验C中没有现察到明显现象,小明认为不能判断Ca(OH)2与稀盐酸是否发生了反应。为了证明Ca(OH)2与稀盐酸确实发生了反应,小明设计用Ca(OH)2溶液、稀盐酸和酚酞试液进行实验的方案、实验过程如图:
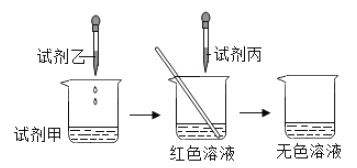
所加试剂甲乙丙分别是:甲_______乙_______丙_______。
写出Ca(OH)2与稀盐酸反应的化学方程式_____________________。
(3)探究拓展:小宇和小娟对实验D反应后过滤得到的无色滤液进行了探究。
小宇猜想溶液中含有一种溶质,是氯化钙;
小娟猜想滤液中含有两种溶质,是氯化钙和_______。
为验证哪位同学的猜想是正确的,请你帮他们设计实验方案并填写下列实验报告:
实验步骤 | 实验现象 | 实验结论 |
取滤液于试管中,加入_____ | ___________________ | 滤液中含有两种溶质。小娟同学的猜想是正确的。 |
【答案】化学 ①Ca(OH)2溶液变浑浊 Ca(OH)2+CO2=CaCO3↓+H2O Ca(OH)2溶液 酚酞试液 稀盐酸 Ca(OH)2+2HCl=CaCl2+2H2O Ca(OH)2 酚酞试液 溶液由无色变为红色
【解析】
(1)上述实验A.B.C中都有新物质生成,所以发生的属于化学变化,探究的是氢氧化钙的化学性质;故填:化学;
(2)①氢氧化钙与二氧化碳反应生成碳酸钙白色沉淀和水,所以实验①中观察到氢氧化钙溶液变浑浊;故填:Ca(OH)2溶液变浑浊;Ca(OH)2+CO2=CaCO3↓+H2O;
②探究Ca(OH)2与稀盐酸确实发生了反应时,可设计如下实验:向氢氧化钙溶液中滴加无色的酚酞试液,观察到溶液变成红色,然后用胶头滴管逐滴加入稀盐酸,当观察到溶液由红色恰好变成无色时,说明二者恰好完全中和,氢氧化钙与盐酸反应生成氯化钙和水;故填:Ca(OH)2溶液;酚酞试液;稀盐酸;Ca(OH)2+2HCl=CaCl2+2H2O;
(3)D实验的溶液是无色的,说明溶液显中性或酸性,即溶液中的溶质是氯化钙或氯化钙与氯化氢。酸性溶液能使紫色的石蕊试液变红色,所以可取滤液于试管中,加入紫色的石蕊试液,若观察到溶液变成红色,则说明滤液中含有两种溶质,即小娟同学的猜想是正确的;故填:氯化氢;紫色的石蕊试液;溶液变成红色。

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案【题目】现有一包黑色固体粉末,可能含有炭粉、CuO、Fe3O4中的两种或者三种,某化学兴趣小组通过实验探究其成分。
(1)提出问题:该黑色固体粉末成分是什么?
(2)作出猜想:
猜想一:混合固体是炭粉、CuO
猜想二:混合固体是炭粉、Fe3O4
猜想三:混合固体是_____(物质写不去不给分)
猜想四:混合固体是炭粉、CuO、Fe3O4
(3)查阅资料:Fe3O4为黑色粉末,能与盐酸反应,含有Fe3+的盐溶液遇到KSCN(硫氰化钾)溶液时变成红色,Fe(OH)2是一种白色沉淀。
(4)实验探究:取一定量的固体于试管中,加足量的盐酸,充分反应后有部分固体溶解,过滤,得到滤液A,并对滤液A的成分进行如下探究:
实验操作 | 实验现象 | 实验结论 |
步骤一:取一定量滤液A于试管中,加入足量的铁粉 | 无红色固体析出 | 该固体物质一定没有_____ |
步骤二:又取一定量的滤液A于试管中,加入少量的KSCN(硫氰化钾)溶液 | 溶液变成红色 | 滤液A中一定含有的物质是_____ |
步骤三:再取一定量的滤液A于试管中,加入足量的NaOH溶液 | 有红褐色沉淀生成,同时还有少量的白色沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色 | 滤液A中还一定含有的物质是_____ |
(5)讨论交流:
①通过以上实验,猜想_____成立。
②写出Fe3O4与盐酸反应的化学方程式:_____。
③四氧化三铁作为铁的一种氧化物,在高温下还能被单质铝还原,同时生成一种稳定的氧化物,请你写出该反应的化学方程式:_____。