题目内容
某同学在查阅资料时得知:市售纯碱样品常混有氯化钠杂质.
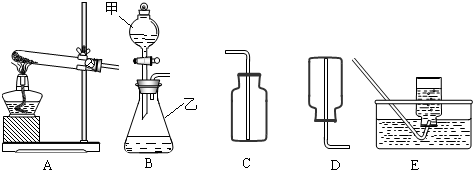
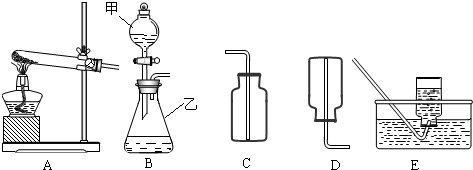
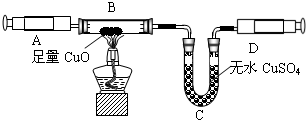
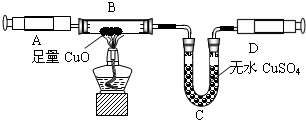
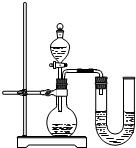
该同学设计了如图中的装置进行实验,测定市售纯碱样品中碳酸钠的质量分数.(水蒸气的影响忽略不计,夹持装置已略去)
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性;
②称量5.5g市售纯碱样品放入烧瓶中,加适量蒸馏水溶解,得到试样溶液;
③从分液漏斗滴入稀硫酸,直到不再产生气体时为止;
④缓缓鼓入一定量的N2;
⑤称量B瓶及溶液的质量,发现增重2.2g.
请回答下列问题:
(1)写出A中发生反应的化学方程式______.
(2)装置C中澄清石灰水的作用是______.
(3)该样品中碳酸钠的质量分数为______%(结果保留到小数点后一位).
【答案】分析:(1)根据方程式的写法考虑;(2)根据氢氧化钙具有检验二氧化碳和吸收二氧化碳的作用考虑;(3)根据二氧化碳的质量计算出碳酸钠的质量,再用碳酸钠的质量除以5.5g乘以百分之百即可.
解答:解:(1)反应物是碳酸钠和硫酸,生成物是硫酸钠、水、二氧化碳,二氧化碳后面标上上升符号;
(2)由于空气中也含有二氧化碳,如果进入B装置,会造成误差,所以石灰水就是吸收空气中二氧化碳,为了防止空气中二氧化碳进入B装置的;
(3)B装置质量的增加量就是生成的二氧化碳的质量,设要生成2.2g二氧化碳需要碳酸钠的质量为X则:
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
X 2.2g
根据: 解得:X=5.3g,该样品中碳酸钠的质量分数为:
解得:X=5.3g,该样品中碳酸钠的质量分数为: ×100%=96.4%;
×100%=96.4%;
故答案为:(1)Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;(2)防止空气中二氧化碳进入B装置;(3)96.4%.
点评:解答本题关键是要知道空气中二氧化碳如果进入B装置,会造成误差,石灰水的作用就是吸收空气中二氧化碳的.
解答:解:(1)反应物是碳酸钠和硫酸,生成物是硫酸钠、水、二氧化碳,二氧化碳后面标上上升符号;
(2)由于空气中也含有二氧化碳,如果进入B装置,会造成误差,所以石灰水就是吸收空气中二氧化碳,为了防止空气中二氧化碳进入B装置的;
(3)B装置质量的增加量就是生成的二氧化碳的质量,设要生成2.2g二氧化碳需要碳酸钠的质量为X则:
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
X 2.2g
根据:
 解得:X=5.3g,该样品中碳酸钠的质量分数为:
解得:X=5.3g,该样品中碳酸钠的质量分数为: ×100%=96.4%;
×100%=96.4%;故答案为:(1)Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;(2)防止空气中二氧化碳进入B装置;(3)96.4%.
点评:解答本题关键是要知道空气中二氧化碳如果进入B装置,会造成误差,石灰水的作用就是吸收空气中二氧化碳的.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验.
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明NaOH溶液与稀盐酸发生了化学反应.
(1)用pH试纸测定溶液的pH时,正确的操作是: .
(2)简述强调“测得的pH小于7”的理由: .
方案二:先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,可观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应.
该组同学在向NaOH溶液中滴加酚酞溶液时,发现了一个意外现象:氢氧化钠溶液中滴入酚酞溶液,溶液变成了红色,过了一会儿红色就消失了.该小组对这种意外现象的原因作了如下猜想:①可能是酚酞溶液与空气中的氧气反应,使红色消失;②可能是氢氧化钠溶液与空气中的二氧化碳反应,使红色消失.
(1)为验证猜想①,该组同学做了如下实验:将配制的氢氧化钠溶液加热,并在液面上方滴一些植物油,然后在冷却后的溶液中滴入酚酞溶液.实验中“加热”和“滴入植物油”目的是 .实验结果表明酚酞溶液红色消失与空气中的氧气无关.
(2)为验证猜想②,该组同学做了如下实验:取了一定量的Na2CO3溶液,在其中滴入酚酞溶液,发现溶液也呈现红色,由此可得出以下两点结论:结论1:说明Na2CO3溶液呈 性;结论2:说明酚酞溶液红色消失与空气中的二氧化碳无关.
(3)该小组同学通过查阅资料得知:当氢氧化钠溶液浓度很大时,就会出现上述意外现象.请设计实验证明该方案中取用的NaOH溶液浓度过大:①实验方法 ,②观察到的现象 .
方案三:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生.如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应.
该组同学将不同浓度的盐酸和NaOH溶液各10mL混合,用温
度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如表).
(1)表中x= .
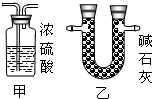
(2)某同学在没使用温度计的情况下,通过右图所示装置完成了实验.则该同学根据 判断NaOH溶液与稀盐酸发生了中和反应.
(3)关于实验中的细节和意外情况:①实验中,稀盐酸必须用胶头滴管逐滴滴加,这样做的目的是 .②实验过程中,要用玻璃棒不断搅拌,这样做的目的是 .③在实验过程中意外发现有气泡出现,你认为原因是 .④发现盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末.他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:①可能是NaOH;你认为:②可能是 ; ③可能是 .
(4)为了进一步研究实验中出现的问题,取了13.3g氢氧化钠固体样品加适量的水配成溶液,向其中加入200g10%的稀盐酸,使其充分反应,生成二氧化碳2.2g.求:
(1)样品中氢氧化钠的质量;
(2)和氢氧化钠反应的盐酸的质量;
(3)在图中画出以纵坐标表示二氧化碳质量,横坐标表示盐酸的质量的关系图.
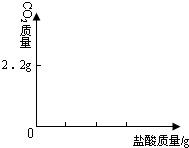
(已知Na2CO3+2HCl═2NaCl+H2O+CO2↑)
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明NaOH溶液与稀盐酸发生了化学反应.
(1)用pH试纸测定溶液的pH时,正确的操作是:
(2)简述强调“测得的pH小于7”的理由:
方案二:先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,可观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应.
该组同学在向NaOH溶液中滴加酚酞溶液时,发现了一个意外现象:氢氧化钠溶液中滴入酚酞溶液,溶液变成了红色,过了一会儿红色就消失了.该小组对这种意外现象的原因作了如下猜想:①可能是酚酞溶液与空气中的氧气反应,使红色消失;②可能是氢氧化钠溶液与空气中的二氧化碳反应,使红色消失.
(1)为验证猜想①,该组同学做了如下实验:将配制的氢氧化钠溶液加热,并在液面上方滴一些植物油,然后在冷却后的溶液中滴入酚酞溶液.实验中“加热”和“滴入植物油”目的是
(2)为验证猜想②,该组同学做了如下实验:取了一定量的Na2CO3溶液,在其中滴入酚酞溶液,发现溶液也呈现红色,由此可得出以下两点结论:结论1:说明Na2CO3溶液呈
(3)该小组同学通过查阅资料得知:当氢氧化钠溶液浓度很大时,就会出现上述意外现象.请设计实验证明该方案中取用的NaOH溶液浓度过大:①实验方法
方案三:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生.如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应.
该组同学将不同浓度的盐酸和NaOH溶液各10mL混合,用温
度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如表).
| 编号 | 盐酸 | NaOH溶液 | △t/℃ |
| 1 | 3.65% | 2.00% | 3.5 |
| 2 | 3.65% | 4.00% | x |
| 3 | 7.30% | 8.00% | 14 |

(1)表中x=
(2)某同学在没使用温度计的情况下,通过右图所示装置完成了实验.则该同学根据
(3)关于实验中的细节和意外情况:①实验中,稀盐酸必须用胶头滴管逐滴滴加,这样做的目的是
(4)为了进一步研究实验中出现的问题,取了13.3g氢氧化钠固体样品加适量的水配成溶液,向其中加入200g10%的稀盐酸,使其充分反应,生成二氧化碳2.2g.求:
(1)样品中氢氧化钠的质量;
(2)和氢氧化钠反应的盐酸的质量;
(3)在图中画出以纵坐标表示二氧化碳质量,横坐标表示盐酸的质量的关系图.

(已知Na2CO3+2HCl═2NaCl+H2O+CO2↑)