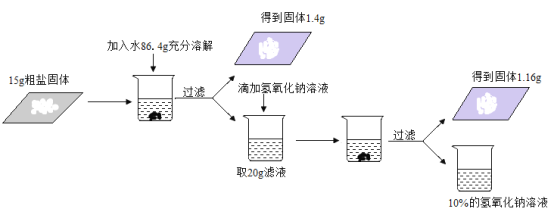
题目内容
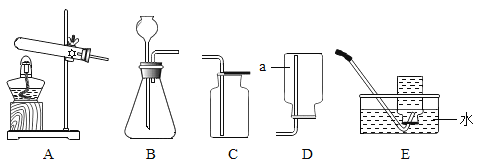
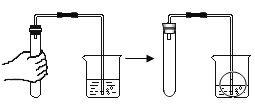
【题目】化学兴趣小组的同学为了探究氢氧化钠的化学性质,做了如图所示实验。
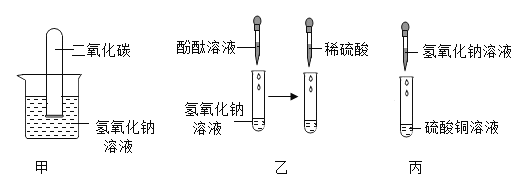
(1)甲实验试管中观察到的现象是_____,反应的化学方程式为_____;此实验不足以证明氢氧化钠和二氧化碳发生了化学反应,因此需补充一个对比实验,请简要写出补充的实验:_____;
(2)乙实验中酚酞溶液的作用是_____;
(3)丙实验观察到试管中有蓝色沉淀生成,上层溶液为无色,证明氢氧化钠和硫酸铜发生了化学反应。实验结束后,小组同学对丙实验试管中无色溶液中溶质的成分展开了探究。
(提出问题)试管中无色溶液溶质的成分是什么?
(猜想与假设)猜想一:硫酸钠和氢氧化钠;
猜想二:_____;
(设计实验)要证明猜想一成立,下列试剂中能达到实验目的的是_____(填字母);
A 紫色石蕊溶液
B 氯化钡溶液
C 氯化镁溶液
(拓展延伸)小组同学总结了氢氧化钠的化学性质,又联想到学过的氢氧化钙,发现二者化学性质相似,原因是在它们的溶液中都含有相同的_____(用符号表示)。
【答案】试管内液面上升 ![]() 将氢氧化钠溶液换成等体积的水,重复上述实验 通过溶液颜色的变化证明反应能否发生 硫酸钠 AC
将氢氧化钠溶液换成等体积的水,重复上述实验 通过溶液颜色的变化证明反应能否发生 硫酸钠 AC ![]()
【解析】
(1)如图所示,甲实验中二氧化碳与氢氧化钠反应生成碳酸钠和水,试管内气压会减小,会观察到的现象是试管内液面上升,反应的化学方程式为![]() ;由于二氧化碳溶于水且与水反应,此实验不足以证明氢氧化钠和二氧化碳发生了化学反应,因此需补充一个对比实验,补充的实验为:将氢氧化钠溶液换成等体积的水,重复上述实验,观察试管内的现象;
;由于二氧化碳溶于水且与水反应,此实验不足以证明氢氧化钠和二氧化碳发生了化学反应,因此需补充一个对比实验,补充的实验为:将氢氧化钠溶液换成等体积的水,重复上述实验,观察试管内的现象;
(2)氢氧化钠溶液呈碱性,乙实验中酚酞溶液滴加到氢氧化钠溶液中,溶液会变成红色,再向溶液中滴加稀硫酸,氢氧化钠与稀硫酸反应生成硫酸钠和水,溶液会由碱性变为中性,硫酸过量变为酸性,酚酞溶液在中性或酸性溶液中为无色,当观察到溶液由红色变为无色时,说明原溶液中氢氧化钠完全反应,因此该实验中酚酞溶液的作用是作为指示剂,通过溶液颜色的变化证明反应能否发生;
(3)由题意丙实验中根据氢氧化钠与硫酸铜反应的情况分析无色溶液中溶质的成分,氢氧化钠与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,硫酸铜溶液呈蓝色,一定不含硫酸铜,若氢氧化钠过量,则为氢氧化钠和硫酸钠,若恰好完全反应,则为硫酸钠;由此可以进行猜想与假设:则猜想二为硫酸钠;
设计实验:
要证明猜想一溶质为硫酸钠和氢氧化钠成立,则有:
A、紫色石蕊溶液加入到碱性溶液中溶液呈蓝色,加入到中性溶液中呈紫色,硫酸钠溶液呈中性,氢氧化钠溶液呈碱性,若加入紫色溶液后溶液变蓝说明含有氢氧化钠,A选项试剂能达到实验目的,符合题意;
B、氯化钡溶液加入到反应后的溶液中,氯化钡与氢氧化钠不反应,氯化钡与硫酸钠反应生成硫酸钡沉淀和氯化钠,因此氯化钡不能说明是否含有氢氧化钠,B选项试剂不能达到实验目的,不符合题意;
C、氯化镁与硫酸钠不反应,氯化镁与氢氧化钠反应生成氢氧化镁沉淀和氯化钠,若加入氯化镁溶液后产生白色沉淀说明含有氢氧化钠,C选项试剂能达到实验目的,符合题意。故选AC。
拓展延伸:
氢氧化钠在水中解离出钠离子和氢氧根,总结氢氧化钠的化学性质,联想到学过的氢氧化钙,氢氧化钙在水中解离出钙离子和氢氧根,发现二者化学性质相似,二者都是碱,原因是在它们的溶液中都含有相同的![]() 。
。

【题目】某小组探究硝酸钾固体的溶解情况,KNO3 在 20℃水中达到饱和时溶解的质量表格,依据如下测定数据分析正确的是( )
水的质量(g) | 25 | 50 | 100 |
KNO3的质量(g) | 7.9 | 15.8 | 31.6 |
A.KNO3溶解后形成的溶液各部分密度相同
B.KNO3 的溶解度随水量的增加而增大
C.20℃时,KNO3饱和溶液的质量分数为 31.6%
D.仅从以上实验数据无法推测KNO3溶解度受温度的影响关系