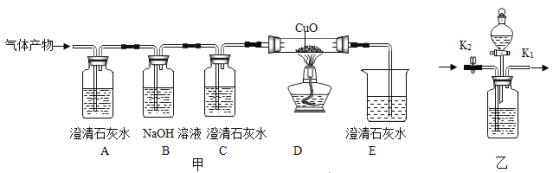
题目内容
【题目】某校化学兴趣小组利用数字化传感器探究
盐酸和氢氧化钠的酸碱中和反应,烧杯中溶液pH变化如图所示。下列说法正确的是( )
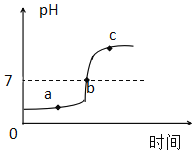
A. 图中a点所示溶液呈碱性
B. 图中c点所示溶液中阴离子只有OH-
C. 图中a点所示溶液中含有的溶质是NaCl和HCl
D. 该实验是将盐酸逐滴滴入氢氧化钠溶液中
【答案】C
【解析】
A、a点时溶液的pH小于7,所示溶液呈酸性,故选项说法错误。
B、c点时溶液的pH大于7,所示溶液呈碱性,所示溶液中阴离子有Cl-、OH-,故选项说法错误。
C、a点时溶液的pH小于7,溶液显酸性,说明稀盐酸过量,所得溶液中的溶质为HCl和NaCl,故选项说法正确。
D、图象中pH值的变化是从小于7逐渐的增大到大于7,可知原溶液显酸性,然后不断的加入碱性溶液,使pH增大,说明是把氢氧化钠溶液滴加到稀盐酸中,故选项说法错误。
故选:C。

【题目】(1)某兴趣小组在制取氧气的实验过程中,有如下实验设计方案,该方案的实验目的是:探究___对反应速率的影响。
编号 | 温度 | 催化剂 | 氯酸钾、二氧化锰的质量比 | 生成1升氧气所需时间/s |
实验I | 400 | MnO2 | 1:1 | 153 |
实验Ⅱ | 400 | MnO2 | 2:1 | 240 |
(2)小林在实验时,联想到了渔民用过氧化钙(CaO2)增加鱼池中的含氧量,提出猜想。
(猜想)过氧化钙与水反应可制取氧气。
实验装置 | 实验主要现象 |
| 试管中加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几乎收集不到气体。 |
实验结论:过氧化钙与水反应(___)(填“能”或“不能”)用于实验室制取氧气。
(分析与反思)小林希望对此实验进行改进,使该反应加快,请你帮他提出合理化建议___。
(3)(计算)该兴趣小组的同学们购得用于增氧的过氧化钙产品(杂质不含钙元素),标签如图所示。试计算:

(1)过氧化钙的相对分子质量为___;
(2)过氧化钙中钙元素与氧元素的质量比为___;
(3)多少克的过氧化钙与100g碳酸钙CaCO3含钙量相当____。(写出计算过程)
【题目】某化学小组进行了如下实验探究。
(提出问题)溶液中复分解反应的实质是什么?
(查阅资料)
①电导率传感器用于测量溶液的导电性强弱,能反应离子浓度大小。
②相同温度下同种溶液电导率越大,离子浓度越大。
(实验一)测定四种溶液的电导率
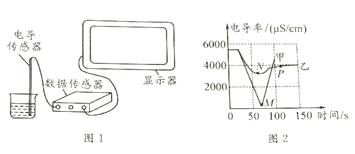
室温下,分别取20mL下列液体于烧杯中,插入电导率传感器如图1,测得数据如下表:(烧杯中的物质静置于空气中备用)
物质 | ①蒸馏水 | ②稀硫酸 | ③氢氧化钠溶液 | ④硫酸钡悬浊液 |
电导率/(μS/cm) | 3 | 5923 | 6316 | 3 |
(1)测出物质①④与物质②③的电导率数据差异巨大的原因是_________。
(实验二)测定氢氧化钡与稀硫酸反应过程中的电导率
室温下,将上述烧杯中的氢氧化钡溶液倒出10mL于另一烧杯中,向其中滴加2-3滴无色酚酞试液,插入电导率传感器,然后滴加稀硫酸,测得溶液的电导率变化如图2中甲曲线所示。
(2)写出氢氧化钡与硫酸反应的化学方程式:___________。
(3)M点时电导率几乎为零的原因是__________.
(4)通过对甲曲线的分析,下列说法错误的是_______(填字母序号)。
A M点前曲线下滑的过程中,H+和OH-结合成H2O,Ba2+和SO42-结合成BaSO4
B M点后溶液电导率逐渐增大,是由于BaSO4进一步解离出Ba2+和SO42-
(实验三)测定氢氧化钡与硫酸钠反应过程中的电导率
室温下,将实验二中稀硫酸改为硫酸钠溶液,重复上述实验,测得溶液的电导率变化如图2中乙曲线所示。
(5)写出硫酸钠与氢氧化钡反应的化学方程式____________。
(6)对比两曲线的最低点,N点比M点明显高的原因是_____,P点时溶液中大量含有的离子是_____(填离子符号)。
(结论)
(7)通过比较分析,结合已学知识可知,溶液中复分解反应的实质是参与反应的离子结合生成了沉淀、气体或水,导致其浓度_______(填“增大”或“减小”)。
(拓展与反思)
(8)向一定量饱和澄清石灰水中持续通入过量的二氧化碳气体,溶液先变浑浊后浑浊逐渐消失。推测此过程的溶液中Ca2+的浓度变化情况是____________。
(9)实验二中刚开始时,氢氧化钡溶液的电导率小于实验一中测得的6316μS/cm,原因可能是________。
(10)若用实验一中物质②与③反应来测定电导率随时间的变化情况,你推测溶液的变化曲线可能是_____________(填“甲”或“乙”)。