题目内容
【题目】从氯碱工业产生的盐泥中回收BaSO4,其主要工艺流程如下图。
已知:①盐泥的主要成分为BaSO4、NaCl、Mg(OH)2和CaCO3。
②BaSO4难溶于水,不与盐酸反应。
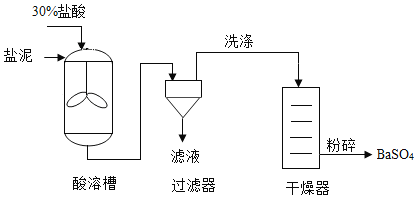
(1)除去NaCl,利用的性质是____。
(2)酸溶槽中发生中和反应的化学方程式为____。
(3)过滤器中分离出来的固体是____。
【答案】NaCl可溶于水 ![]() BaSO4
BaSO4
【解析】
(1)除去盐泥中的NaCl,是利用了NaCl可溶于水的性质;
故填:NaCl可溶于水;
(2)中和反应是酸与碱作用生成盐和水的反应,所以酸溶槽中发生的中和反应是盐泥中的氢氧化镁与所加的盐酸反应生成氯化镁和水,化学方程式为:![]() ;
;
故填:![]() ;
;
(3)盐泥的主要成分为BaSO4、NaCl、Mg(OH)2和CaCO3,NaCl可溶于水,Mg(OH)2和CaCO3能与加入的盐酸反应,生成能溶于水的氯化镁和氯化钙,BaSO4难溶于水,不与盐酸反应,所以过滤器中分离出来的固体是BaSO4;
故填:BaSO4。

【题目】日常生活中,每位同学都会接触到硬水。某校化学兴趣小组的同学在老师的带领下对硬水进行了一些探究和拓展实验。
[查阅资料]水的硬度是由水中溶解的可溶性钙和镁化合物引起的,硬水中溶解的钙和镁化合物可分为两类:钙、镁的碳酸氢盐:钙、镁的硫酸盐或氯化物,一般所说的水的硬度是由上述两类化合物引起的。
[实验探究一]小组同学对硬水中为什么含有碳酸氢钙非常感兴趣,于是再次学习九年级化学下册课本中的资料卡片:石笋和钟乳石的形成。知道了当石灰岩遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:CaCO3+CO2+H2O=Ca(HCO3)2
小组同学思考:若向碳酸钠溶液中通入一定量的二氧化碳,是否也能生成碳酸氢钠?于是他们对此开始实验探究(不考虑二氧化碳和碳酸作为溶质的情况)
[提出问题]所得溶液中溶质是什么?
[提出猜想]
猜想一:溶质为Na2CO3;
猜想二:______。
猜想三:溶质为Na2CO3和NaHCO3
[设计实验]
实验步骤 | 实验现象 | 实验结论 |
a.取所得溶液少许于试管中,向其中滴加过量的CaCl2溶液 | ______ | 猜想二不成立 |
b..______ | 有气泡冒出 | 猜想一不成立 |
通过实验,小组同学得出了正确结论。
[实验探究二]热水瓶用久后,瓶胆内壁常附着一层水垢, 老师说其成分主要是碳酸钙、氢氧化镁等。小组同学认为可使用醋酸(HAc)除去,请写出其中发生中和反应的化学方程式_____。
[实验探究三]小组同学还对稀盐酸和氢氧化钠溶液发生中和反应进行了如下探究:
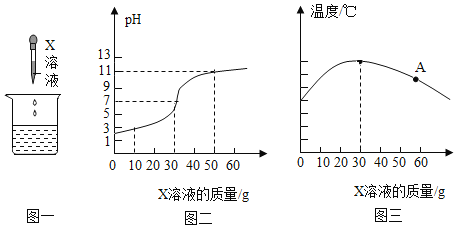
用pH传感器测得烧杯内溶液的pH变化图象(如图二),同时用温度传感器别得烧杯内温度变化图象(如图三),实验过程中保温良好,忽略热量散失。
Ⅰ.由图一、图二所示实验可知X溶液为______。
Ⅱ.请分析图三,能得到的结论是_______。
III.图三中A点对应溶液中的溶质有______。
【题目】近年来,我国高铁飞速发展,已成为世界上唯一高铁成网运行的国家。请回答下列问题。
实验一 | 实验二 | 实验三 | |
实验操作 |
|
|
|
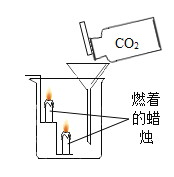
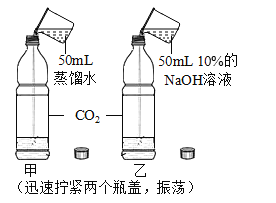
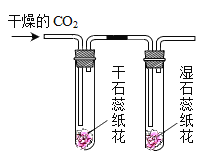
实验现象 | 蜡烛火焰___ | 软塑料瓶变瘪程度较大的是_(选填“甲”或“乙”) | 干石蕊纸花不变色, 湿石蕊纸花变红色 |
实验结论 | ①二氧化碳的密度比空气大; ②二氧化碳既不能燃烧,也不能支持燃烧 | 二氧化碳能与氢氧化钠发生反应 | _____ |
(1)制造高铁列车使用了多种材料。下列高铁列车的部件中,其主要材料属于金属材料的是_____(选填字母序号)。
A、玻璃车窗 B、镁铝合金车体
C、塑料小桌板 D、涤纶座套
(2)高铁电路多用铜质导线,这是利用了铜的延展性和__性。
(3)高铁刹车片由合金锻钢制作,时速300公里以上的列车紧急制动时,轮毂盘面和刹车片的温度瞬间达到 700℃以上,合金锻钢应该具备耐磨和__等特性。
(4)建造高铁需要消耗大量的铝、铁等金属。工业炼铁的原理是氧化铁(Fe2O3)和一氧 化碳在高温条件下反应,其化学方程式为_______。
(5)车身表面烤漆不仅美观,还能起到防锈的作用。其防锈的原理是_______。
(6)目前世界上已有 50%以上的铁得到了回收利用。回收利用废旧金属的社会意义是_____(写出一条即可)。
【题目】不同温度下KNO3的溶解度如下表所示。下列说法正确的是
温度/℃ | 20 | 30 | 40 |
溶解度/g | 31.6 | 45.8 | 63.9 |
A.20℃时,100gKNO3饱和溶液中溶质质量为31.6g
B.30℃时,100gKNO3饱和溶液的溶质质量分数为45.8%
C.30℃时,将50gKNO3放入100g水中得到150g溶液
D.40℃时,100g水最多溶解63.9gKNO3
【题目】酸钙为白色固体,易溶于水,可作食品防霉剂,国家标准规定了其用于制作面食、糕点时每千克面粉中的最大使用量。小组同学实验探究其性质和防霉的效果。
I.探究丙酸钙的性质
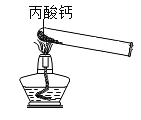
(进行实验)用下图裝置(夹持仪器已略去)完成实验,记录如下:
序号 | ① | ② |
装置 |
|
|
现象 | 试管内壁有水雾 | 注入酸后,有气泡产生,石灰水变浑浊 |
(解释与结论)
(1)②中现象说明有CO2产生。CO2与石灰水反应的化学方程式为________。
(2)查阅资料得知丙酸钙与盐酸反应无气体生成。由实验②可得出的结论是_______。
Ⅱ.探究丙酸钙防霉的效果
(进行实验)分别按下列①~⑧的配方蒸制8个馒头,冷却后置于密封袋中,记录如下:
组别 | 第1组 | 第2组 | |||||||
序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
配方 | 面粉/ g | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 50 |
酵母/ g | 0.75 | 0.75 | 0.75 | 0.75 | 0.75 | 0.75 | 0.75 | 0.75 | |
蔗糖/ g | 0 | 0 | 0 | 0 | 5 | 5 | x | 5 | |
丙酸钙/g | 0 | 0.06 | 0.10 | 0.15 | 0 | 0.06 | 0.10 | 0.15 | |
开始发霉时间 | 第3天 | 第4天 | 第5天 | 第6天 | 第3天 | 第4天 | 第5天 | 第6天 | |
(解释与结论)
(3)设计第1组实验的目的是____。
(4)第2组,⑦中x为_______。
(5)对比第1组、第2组实验可得到的结论是______。
(反思与评价)
(6)某同学认为“制作面食、糕点时,丙酸钙用量越大越好”你是否同意此观点,并说明理由:_____。