题目内容
(1)海水晒盐可得到粗盐和苦卤,其中苦卤是食盐的 (填“饱和”或“不饱和”)溶液,理由是 ,利用苦卤.石灰乳.稀盐酸可制得应用于飞机制造业的金属镁。其中发生反应的化学方程式是① ;② ;③ 。
(2)一包从海水中获得的粗盐,其中含有少量的泥沙等不溶性杂质,可采用以下步骤除去 , , 。
课外活动小组对经过初步提纯的粗盐的成分进行探究,并将粗盐进一步提纯。
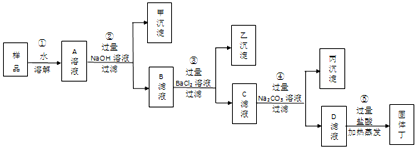
(3)探究一:这包粗盐中还有什么杂质?根据海水的成份和初步提纯的实验操作,估计粗盐中可能还有杂质是CaCl2和MgCl2,现用实验验证这种推测:取样并溶解,加入数滴NaOH溶液,目的是检验有没有 (化学式) ,相关的反应方程式为 ;接着再加入数滴Na2CO3溶液,目的是检验其有没有 (化学式),相关的反应方程式为 。实验证明,这包粗盐中含有的杂质是CaCl2。
(4)探究二:这包粗盐中NaCl的质量分数是多少?按下面步骤继续进行实验:
①称取一定质量的样品;②将样品加水溶解制成粗盐溶液;③向粗盐溶液中加入过量某种试剂,过滤;④沉淀洗涤后小心烘干得到纯净固体A;⑤滤液在进行某一操作后,移入蒸发皿蒸发,得到纯净固体B;⑥称量实验中得到的某种固体。
②③⑤步骤中,都使用到同一仪器(填名称) ,在步骤②和⑤中使用这种仪器采用了相同操作,但目的不同,在步骤②中的目的是 ,在步骤⑤中的目的是 。步骤③中加入试剂是(化学式) ,相关反应方程式为 。步骤⑤进行的“某一操作”是 ,目的是 ,相关反应方程式为 。步骤⑥中,你认为需要称量的固体是A还是B? (填A或B)你不选择称量另一种固体的理由是 。
(2)一包从海水中获得的粗盐,其中含有少量的泥沙等不溶性杂质,可采用以下步骤除去 , , 。
课外活动小组对经过初步提纯的粗盐的成分进行探究,并将粗盐进一步提纯。
(3)探究一:这包粗盐中还有什么杂质?根据海水的成份和初步提纯的实验操作,估计粗盐中可能还有杂质是CaCl2和MgCl2,现用实验验证这种推测:取样并溶解,加入数滴NaOH溶液,目的是检验有没有 (化学式) ,相关的反应方程式为 ;接着再加入数滴Na2CO3溶液,目的是检验其有没有 (化学式),相关的反应方程式为 。实验证明,这包粗盐中含有的杂质是CaCl2。
(4)探究二:这包粗盐中NaCl的质量分数是多少?按下面步骤继续进行实验:
①称取一定质量的样品;②将样品加水溶解制成粗盐溶液;③向粗盐溶液中加入过量某种试剂,过滤;④沉淀洗涤后小心烘干得到纯净固体A;⑤滤液在进行某一操作后,移入蒸发皿蒸发,得到纯净固体B;⑥称量实验中得到的某种固体。
②③⑤步骤中,都使用到同一仪器(填名称) ,在步骤②和⑤中使用这种仪器采用了相同操作,但目的不同,在步骤②中的目的是 ,在步骤⑤中的目的是 。步骤③中加入试剂是(化学式) ,相关反应方程式为 。步骤⑤进行的“某一操作”是 ,目的是 ,相关反应方程式为 。步骤⑥中,你认为需要称量的固体是A还是B? (填A或B)你不选择称量另一种固体的理由是 。
(1)饱和;里面有析出的食盐晶体;MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2;Mg(OH)2+2HCl=MgCl2+2H2O
MgCl2 Mg+Cl2↑
Mg+Cl2↑
(2)溶解;过滤;蒸发
(3)MgCl2;MgCl2+2NaOH=Mg(OH)2↓+2NaCl;CaCl2;CaCl2+Na2CO3=CaCO3↓+2NaCl
(4)玻璃棒;加速粗盐的溶解;防止由于局部温度过高,造成液滴飞溅;Na2CO3;
CaCl2+Na2CO3=CaCO3↓+2NaCl;加入适量或过量的稀盐酸;除去过量的碳酸钠;
Na2CO3+2HCl=2NaCl+H2O+CO2↑;A;B中含有反应生成的氯化钠
MgCl2
 Mg+Cl2↑
Mg+Cl2↑(2)溶解;过滤;蒸发
(3)MgCl2;MgCl2+2NaOH=Mg(OH)2↓+2NaCl;CaCl2;CaCl2+Na2CO3=CaCO3↓+2NaCl
(4)玻璃棒;加速粗盐的溶解;防止由于局部温度过高,造成液滴飞溅;Na2CO3;
CaCl2+Na2CO3=CaCO3↓+2NaCl;加入适量或过量的稀盐酸;除去过量的碳酸钠;
Na2CO3+2HCl=2NaCl+H2O+CO2↑;A;B中含有反应生成的氯化钠

练习册系列答案
相关题目