题目内容
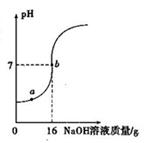
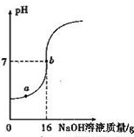
实验室欲测定一瓶标签破损的稀H2SO4的溶质质量分数.现取10g稀硫酸样品,将5%的NaOH溶液逐滴加到样品中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示.试回答:(1)a点溶液中含有的离子有______.
(2)当pH=7时,消化NaOH溶液中的NaOH的质量为______g.
(3)计算稀H2SO4的溶质质量分数.

【答案】分析:(1)根据溶液的pH、稀H2SO4与NaOH溶液的反应分析溶液中存在的离子;
(2)根据溶质质量分数的计算公式计算;
(3)根据稀H2SO4与NaOH溶液的反应的方程式,由NaOH的质量求出稀H2SO4的溶质稀H2SO4的溶质质量分数,
再求出稀H2SO4的溶质质量分数.
解答:解:(1)由图示可知,在a点时溶液的pH小于7,说明加入的NaOH完全反应,有剩余的硫酸,所以,溶液中含有的离子为:Na+、H+、SO42;
(2)由图示可知,在溶液的pH等于7,消耗的NaOH溶液的质量为16g,溶质的质量为:16g×5%=0.8g;
(3)10g稀硫酸样品含有H2SO4的质量为x
2NaOH+H2SO4═Na2SO4+2H2O
80 98
0.8g x
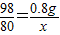 解得:x=0.98g
解得:x=0.98g
稀H2SO4的溶质质量分数为: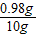 ×100%=9.8%
×100%=9.8%
故答为:(1)Na+、H+、SO42-;(2)0.8;(3)稀H2SO4的溶质质量分数是9.8%
点评:此题是一道结合图象的计算题,解题时找到PH=7的恰好反应点,并利用化学方程式的计算进行解决是解题的突破口.
(2)根据溶质质量分数的计算公式计算;
(3)根据稀H2SO4与NaOH溶液的反应的方程式,由NaOH的质量求出稀H2SO4的溶质稀H2SO4的溶质质量分数,
再求出稀H2SO4的溶质质量分数.
解答:解:(1)由图示可知,在a点时溶液的pH小于7,说明加入的NaOH完全反应,有剩余的硫酸,所以,溶液中含有的离子为:Na+、H+、SO42;
(2)由图示可知,在溶液的pH等于7,消耗的NaOH溶液的质量为16g,溶质的质量为:16g×5%=0.8g;
(3)10g稀硫酸样品含有H2SO4的质量为x
2NaOH+H2SO4═Na2SO4+2H2O
80 98
0.8g x
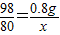 解得:x=0.98g
解得:x=0.98g稀H2SO4的溶质质量分数为:
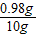 ×100%=9.8%
×100%=9.8%故答为:(1)Na+、H+、SO42-;(2)0.8;(3)稀H2SO4的溶质质量分数是9.8%
点评:此题是一道结合图象的计算题,解题时找到PH=7的恰好反应点,并利用化学方程式的计算进行解决是解题的突破口.

练习册系列答案
相关题目
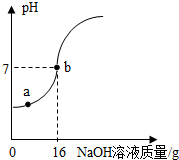 (2013?太原)实验室欲测定一瓶标签破损的稀H2SO4的溶质质量分数.现取10g稀硫酸样品,将5%的NaOH溶液逐滴加到样品中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示.试回答:
(2013?太原)实验室欲测定一瓶标签破损的稀H2SO4的溶质质量分数.现取10g稀硫酸样品,将5%的NaOH溶液逐滴加到样品中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示.试回答: