题目内容
将盛有50g稀盐酸的烧杯放在天平上,然后把过量的碳酸钠加入到盛有稀盐酸的烧杯中,以测定稀盐酸中HCl的质量分数.已知反应前烧杯内稀盐酸和碳酸钠的总质量为60.0g,从反应开始至以后的6分钟内,每1分钟读1次数并记录.结果如下:| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 质量/g | 60.0 | 58.0 | 57.0 | 56.8 | 56.7 | 57.2 | 56.7 |
(1)表中有一个测定结果误差较大,这点所在的时间是第
(2)在给出的坐标纸上,画出表示反应过程的质量与时间的曲线图
 ;
;(3)试计算50g稀盐酸中HCl的质量分数(写出计算过程).
分析:(1)过量碳酸钠与稀盐酸反应时,烧杯内物质的总质量应先逐渐减小,最后保持不变.由于第5分钟时烧杯内物质总质量增大,说明测定结果误差较大.
(2)根据表中数据先点出对应的点,然后再用曲线将其连接起来即可.
(3)由减少的质量根据碳酸钠与盐酸反应的化学方程式可以计算出稀盐酸中溶质的质量分数.
(2)根据表中数据先点出对应的点,然后再用曲线将其连接起来即可.
(3)由减少的质量根据碳酸钠与盐酸反应的化学方程式可以计算出稀盐酸中溶质的质量分数.
解答:解:(1)过量碳酸钠与稀盐酸反应时,烧杯内物质的总质量应先逐渐减小,最后保持不变.由于第5分钟时烧杯内物质总质量增大,说明测定结果误差较大.
(2)见图
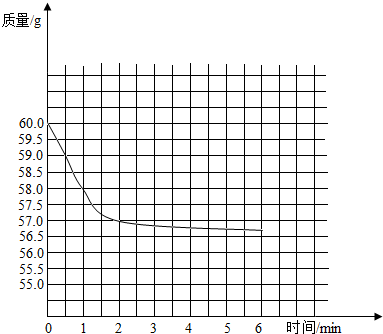 ;
;
(3)设稀盐酸中溶质的质量分数为x.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
73 44
50g×x 60.0g-56.7g
=
,x=10.95%
答:(3)稀盐酸中溶质的质量分数为10.95%.
(2)见图
 ;
;(3)设稀盐酸中溶质的质量分数为x.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
73 44
50g×x 60.0g-56.7g
| 73 |
| 44 |
| 50g×x |
| 60.0g-56.7g |
答:(3)稀盐酸中溶质的质量分数为10.95%.
点评:(1)反应过程中烧杯中的总质量理论上只能减少,不会增加,由此可以找出产生误差较大的范围.
(2)曲线的画出应结合数学上曲线的画法.
(3)由减少的质量根据碳酸钠与盐酸反应的化学方程式直接计算出的是稀盐酸中溶质的质量,而不是稀盐酸中溶质的质量分数.
(2)曲线的画出应结合数学上曲线的画法.
(3)由减少的质量根据碳酸钠与盐酸反应的化学方程式直接计算出的是稀盐酸中溶质的质量,而不是稀盐酸中溶质的质量分数.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
将盛有50g稀盐酸的烧杯放在天平上,然后把过量的碳酸钠加入到盛有稀盐酸的烧杯中,以测定稀盐酸中HCl的质量分数。已知反应前烧杯内稀盐酸和碳酸钠的总质量为60.0g, 从反应开始至以后的6分钟内,每1分钟读1次数并记录。结果如下:

试回答下列问题:
(1)表中有一个测定结果误差较大,这点所在的时间是第_______min;
(2)在给出的坐标纸上,画出表示反应过程的质量与时间的曲线图;
(3)试计算50g稀盐酸中HCl的质量分数(写出计算过程)。

| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 质量/g | 60.0 | 58.0 | 57.0 | 56.8 | 56.7 | 57.2 | 56.7 |
(1)表中有一个测定结果误差较大,这点所在的时间是第_______min;
(2)在给出的坐标纸上,画出表示反应过程的质量与时间的曲线图;
(3)试计算50g稀盐酸中HCl的质量分数(写出计算过程)。
将盛有50g稀盐酸的烧杯放在天平上,然后把过量的碳酸钠加入到盛有稀盐酸的烧杯中,以测定稀盐酸中HCl的质量分数。已知反应前烧杯内稀盐酸和碳酸钠的总质量为60.0g, 从反应开始至以后的6分钟内,每1分钟读1次数并记录。结果如下:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 质量/g | 60.0 | 58.0 | 57.0 | 56.8 | 56.7 | 57.2 | 56.7 |
(1)表中有一个测定结果误差较大,这点所在的时间是第_______min;
(2)在给出的坐标纸上,画出表示反应过程的质量与时间的曲线图;
(3)试计算50g稀盐酸中HCl的质量分数(写出计算过程)。
将盛有50g稀盐酸的烧杯放在天平上,然后把过量的碳酸钠加入到盛有稀盐酸的烧杯中,以测定稀盐酸中HCl的质量分数.已知反应前烧杯内稀盐酸和碳酸钠的总质量为60.0g,从反应开始至以后的6分钟内,每1分钟读1次数并记录.结果如下:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 质量/g | 60.0 | 58.0 | 57.0 | 56.8 | 56.7 | 57.2 | 56.7 |
(1)表中有一个测定结果误差较大,这点所在的时间是第________min;
(2)在给出的坐标纸上,画出表示反应过程的质量与时间的曲线图
 ;
;(3)试计算50g稀盐酸中HCl的质量分数(写出计算过程).
将盛有50g稀盐酸的烧杯放在天平上,然后把过量的碳酸钠加入到盛有稀盐酸的烧杯中,以测定稀盐酸中HCl的质量分数.已知反应前烧杯内稀盐酸和碳酸钠的总质量为60.0g,从反应开始至以后的6分钟内,每1分钟读1次数并记录.结果如下:
试回答下列问题:
(1)表中有一个测定结果误差较大,这点所在的时间是第______min;
(2)在给出的坐标纸上,画出表示反应过程的质量与时间的曲线图
 ;
;
(3)试计算50g稀盐酸中HCl的质量分数(写出计算过程).
| 时间/min | 1 | 2 | 3 | 4 | 5 | 6 | |
| 质量/g | 60.0 | 58.0 | 57.0 | 56.8 | 56.7 | 57.2 | 56.7 |
(1)表中有一个测定结果误差较大,这点所在的时间是第______min;
(2)在给出的坐标纸上,画出表示反应过程的质量与时间的曲线图
 ;
;(3)试计算50g稀盐酸中HCl的质量分数(写出计算过程).