题目内容
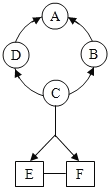
【题目】下列框图中的物质均为初中化学常见的物质,其中A是建筑材料的主要成分,B属于氧化物,下图是它们之间的相互转化关系。请回答:

(1)写出下列物质的化学式:A_________,C____________,指出C的一种用途_________。
(2)得到F溶液的操作I的名称是_____________。
(3)若I是蓝色沉淀,请写出G+F→I的化学方程式:__________________________;若I是红褐色沉淀,则I沉淀的化学式是____________。
(4)写出反应①的化学方程式_________________________,其基本类型是________反应。
【答案】 CaCO3 CO2 灭火 过滤 CuCl2+2NaOH=Cu(OH)2↓+2NaCl Fe(OH)3 CaO+H2O=Ca(OH)2 化合
【解析】(1)A是建筑材料的主要成分,根据课本知识可知A可能是碳酸钙,其化学式为CaCO3;A碳酸钙高温分解生成无色气体C二氧化碳(其化学式为CO2)和白色固体D氧化钙;则A是CaCO3;C是CO2;CO2常用来灭火或作致冷剂等;
(2)D氧化钙与水化合生成E氢氧化钙;E氢氧化钙溶液与碳酸钠溶液反应生成碳酸钙沉淀和F氢氧化钠溶液;碳酸钙沉淀是固体,氢氧化钠溶液是液体,由它们组成的混合物适合用过滤的方法分离;
(3)若I是蓝色沉淀,则I是氢氧化铜,根据质量守恒定律可知:B、G中都含有铜元素,因此B是CuO,G是氯化铜溶液,生成氢氧化铜蓝色沉淀的化学方程式为CuCl2+2NaOH=Cu(OH)2↓+2NaCl;
若I是红褐色沉淀,根据质量守恒定律可知:B、G中都含有铁元素,因此B是铁的氧化物,G是氯化铁溶液,F氢氧化钠溶液与G氯化铁溶液反应生成H红褐色沉淀氢氧化铁和氯化钠,该反应的化学方程式为:3NaOH+FeCl3═Fe(OH)3↓+3NaCl;
(4)D氧化钙与水化合生成E氢氧化钙;该反应由两种物质反应生成一种物质,符合化合反应的概念,属于化合反应;

 阅读快车系列答案
阅读快车系列答案【题目】九年级(三)班化学兴趣小组为测定大理石中碳酸钙的含量,如下图所示:
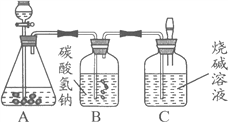
将过量的稀盐酸加入到20 g大理石中(其他成分不与盐酸反应),把产生的CO2气体用足量的烧碱溶液吸收,同时测量C瓶烧碱溶液增加的质量,结果如下表所示:
时间 / 分 | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
C增加质量/C | 0 | 3.0 | 5.0 | 6.0 | 6.6 | x | 6.6 |
(1)上表中,第10分钟时,x= 。
(2)计算大理石样品中碳酸钙的质量分数。
(3)请在下图的坐标纸上,以时间为横坐标,以产生CO2气体的质量为纵坐标,画出能够表明产生气体的质量随时间变化规律的关系曲线;
(4)B中所装药品为碳酸氢钠溶液,作用是吸收可能挥发的HCl气体,你认为对测量结果有没有影响? (填“有”或“没有”)