题目内容
某样品为铜和氧化铜的混合物,为测定该样品中氧化铜的含量,取20g此样品,分四次向其中加入稀盐酸与之充分反应.每次所用的盐酸的质量与反应后剩余固体的质量见下表:
| 第次 | 加入稀盐酸的体积/ml | 剩余固体的质量/g |
| 1 | 40 | 16 |
| 2 | 40 | 12 |
| 3 | 40 | 8 |
| 4 | 40 | 8 |
(2)样品中氧化铜的质量分数为________.
(3)稀盐酸溶质质量分数.(计算结果保留两位小数)________.
解:
(1)由表中第1、2、3次反应情况可以得出,每加入40g稀盐酸,可以和16g-12g=4g氧化铜发生反应,而第四次,剩余物质质量不再变化,说明氧化铜已反应完,剩余物质为铜;故答案为:8g.
(2)由表中数据可知,混合物中铜的质量为8g,那么样品中氧化铜的质量分数为: =60%.
=60%.
故答案为:60%.
(3)设第一次参与反应的HCl的质量为x,
CuO+2HCl═CuCl2+H2O
80 73
4g x
∴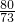 =
=
解之得:x=3.65g,
盐酸中溶质的质量分数为: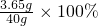 =9.13%
=9.13%
故答案为:9.13%
分析:(1)因为Cu的金属活动性在(H)之后,故铜不能和稀盐酸发生置换反应,因此只有氧化铜和盐酸发生了反应.由表中第1、2、3次反应情况可以得出,每加入40g稀盐酸,可以和16g-12g=4g氧化铜发生反应,而第四次,剩余物质质量不再变化,说明氧化铜已反应完;
(2)根据(1)中计算出的铜的质量,可已求出混合物中氧化铜的质量,然后根据质量分数公式计算即可.
(3)根据反应的化学方程式,得出各物质之间的质量比,列出比例式,就可计算出第一次参与反应的HCl的质量,然后根据溶质质量分数公式计算即可
点评:本题主要考查学生运用化学方程式和质量分数进行计算的能力.
(1)由表中第1、2、3次反应情况可以得出,每加入40g稀盐酸,可以和16g-12g=4g氧化铜发生反应,而第四次,剩余物质质量不再变化,说明氧化铜已反应完,剩余物质为铜;故答案为:8g.
(2)由表中数据可知,混合物中铜的质量为8g,那么样品中氧化铜的质量分数为:
 =60%.
=60%.故答案为:60%.
(3)设第一次参与反应的HCl的质量为x,
CuO+2HCl═CuCl2+H2O
80 73
4g x
∴
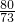 =
=
解之得:x=3.65g,
盐酸中溶质的质量分数为:
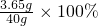 =9.13%
=9.13%故答案为:9.13%
分析:(1)因为Cu的金属活动性在(H)之后,故铜不能和稀盐酸发生置换反应,因此只有氧化铜和盐酸发生了反应.由表中第1、2、3次反应情况可以得出,每加入40g稀盐酸,可以和16g-12g=4g氧化铜发生反应,而第四次,剩余物质质量不再变化,说明氧化铜已反应完;
(2)根据(1)中计算出的铜的质量,可已求出混合物中氧化铜的质量,然后根据质量分数公式计算即可.
(3)根据反应的化学方程式,得出各物质之间的质量比,列出比例式,就可计算出第一次参与反应的HCl的质量,然后根据溶质质量分数公式计算即可
点评:本题主要考查学生运用化学方程式和质量分数进行计算的能力.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案
相关题目
某样品为铜和氧化铜的混合物,为测定其中氧化铜的质量分数,小汶同学设计了以下两种方案:
方案一:取20 g此样品于试管中然后通入氢气并加热至完全反应,通过测定剩余固体的质量来求算;
方案二:取20 g此样品,加入足量稀盐酸,通过测定反应后剩余固体的质量来求算.
(1)你选择的方案是: 理由是:
小青同学将80 g稀盐酸分四次加入样品中,每次充分反应后经过滤、洗涤、干燥等操作,最后称量,所得数据见下表:
(2)上表中n的数值为 .
(3)样品中氧化铜的质量分数是 .
(4)求盐酸中溶质的质量分数(写出计算过程).
方案一:取20 g此样品于试管中然后通入氢气并加热至完全反应,通过测定剩余固体的质量来求算;
方案二:取20 g此样品,加入足量稀盐酸,通过测定反应后剩余固体的质量来求算.
(1)你选择的方案是:
小青同学将80 g稀盐酸分四次加入样品中,每次充分反应后经过滤、洗涤、干燥等操作,最后称量,所得数据见下表:
| 序号 | 加入稀盐酸的质量/g | 剩余固体的质量/g |
| 第1次 | 20 | 16 |
| 第2次 | 20 | 12 |
| 第3次 | 20 | 8.5 |
| 第4次 | 20 | n |
(3)样品中氧化铜的质量分数是
(4)求盐酸中溶质的质量分数(写出计算过程).
某样品为铜和氧化铜的混合物,现对其进行成分分析,取10g此样品,将其分五次加入稀硫酸中,使之充分反应,每次所用稀硫酸的质量及剩余固体质量记入下表
试回答下列问题.
(1)10g样品中,氧化铜的质量为 ;
(2)10g样品中,铜元素的质量总共为 ;
(3)足量稀硫酸与10g此样品完全反应后,可生成硫酸铜 .
| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 加入稀硫酸的质量/g | 2 | 2 | 2 | 2 | 2 |
| 充分反应后剩余固体质量/g | 8 | 6 | 4 | 2 | 2 |
(1)10g样品中,氧化铜的质量为
(2)10g样品中,铜元素的质量总共为
(3)足量稀硫酸与10g此样品完全反应后,可生成硫酸铜
某样品为铜和氧化铜的混合物,为测定其中氧化铜的质量分数,取20g此样品,将80g稀盐酸分四次加入样品中,每次充分反应后经过滤、洗涤、干燥等操作,最后称量,所得数据见下表:
(1)上表中n的数值为 .
(2)样品中氧化铜的质量分数是 .
(3)求盐酸中溶质的质量分数 .
| 序号 | 加入稀盐酸的质量/g | 剩余固体的质量/g |
| 第1次 | 20 | 16 |
| 第2次 | 20 | 12 |
| 第3次 | 20 | 8.5 |
| 第4次 | 20 | n |
(2)样品中氧化铜的质量分数是
(3)求盐酸中溶质的质量分数
某样品为铜和氧化铜的混合物,为测定该样品中氧化铜的含量,取20g此样品,分四次向其中加入稀盐酸与之充分反应.每次所用的盐酸的质量与反应后剩余固体的质量见下表:
求:(1)20g此样品中铜的质量为 .
(2)样品中氧化铜的质量分数为 .
(3)稀盐酸溶质质量分数.(计算结果保留两位小数) .
| 第次 | 加入稀盐酸的体积/ml | 剩余固体的质量/g |
| 1 | 40 | 16 |
| 2 | 40 | 12 |
| 3 | 40 | 8 |
| 4 | 40 | 8 |
(2)样品中氧化铜的质量分数为
(3)稀盐酸溶质质量分数.(计算结果保留两位小数)