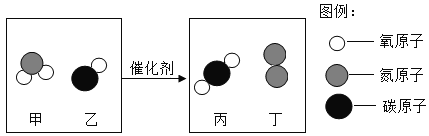
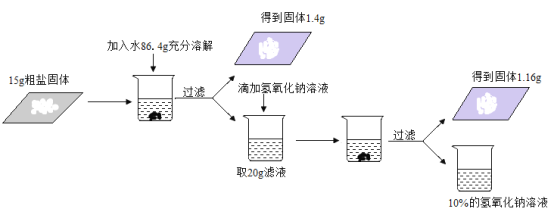
题目内容
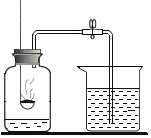
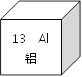
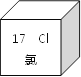
【题目】某化学兴趣小组的同学想从含有Al2(SO4)3、CuSO4的废液中回收金属铜,设计流程如图:
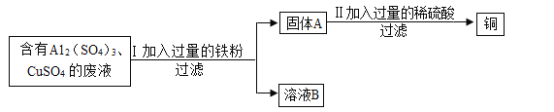
(1)过滤操作中用到的所有玻璃仪器为_____。
(2)I中有关反应的化学方程式为_____。
(3)溶液B中所含的溶质是_____;固体A的成分是_____。(均填化学式)
(4)Ⅱ中有关反应的化学方程式为_____。
【答案】漏斗、玻璃棒、烧杯 ![]() Al2(SO4)3、FeSO4 Cu、Fe
Al2(SO4)3、FeSO4 Cu、Fe ![]()
【解析】
(1)过滤操作中用到的所有玻璃仪器为漏斗、玻璃棒、烧杯,过滤需要漏斗,玻璃棒引流,烧杯盛放滤液;
(2)向含有Al2(SO4)3、CuSO4的废液中加入铁,铁的金属活动性强于铜但是弱与铝,因此铁与硫酸铜反应生成硫酸亚铁和铜,不和硫酸铝反应,反应的方程式为:![]() 。
。
(3)铁不同硫酸铝反应,所以溶液B中的溶质有硫酸铝,铁与硫酸铜反应生成硫酸亚铁,铁过量,所以没有硫酸铜,有生成的硫酸亚铁,所以溶质为硫酸亚铁和硫酸铝;固体A有置换出的铜,还有未反应的铁;
(4)铁与稀硫酸反应生成硫酸亚铁和氢气,反应的方程式为: ![]() 。
。

【题目】分类、类比和推理是学习化学常用的方法。
(1)化学实验可按其主要目的分为:探究化学反应的质量变化,探究物质的性质,探究物质的含量等,据此应将下列实验中的 B 与__________(填“A”或“C”或“D”)归为一类,依据是___。
|
|
|
|
A | B | C | D |
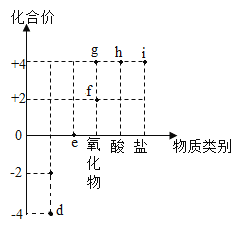
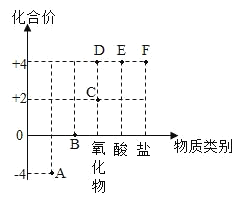
(2)以化合价为纵坐标,物质类别为横坐标所绘制的图象叫价类图如图为碳的价类图,例如 C 点可能标示+2 价的碳的氧化物,则 B 点对应的物质类别是_____。查资料可知:元素处于最高价,只有氧化性:元素处于最低价,只有还原性,则 C 点对应的物质可能具有的性质是_________。
【题目】为测定硫酸钠和硫酸镁固体混合物中硫酸镁的质量分数。某同学取固体混合物26.2g,向其中加入219.6g水,使其完全溶解配制成混合溶液。将200g一定溶质质量分数的氢氧化钠溶液平均分成5等份,依次加入到上述混合溶液中,生成沉淀的质量与加入氢氧化钠溶液的质量关系如下表:
次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
氢氧化钠溶液质量/g | 40 | 40 | 40 | 40 | 40 |
产生沉淀质量/g | 1.45 | 2.9 | m | 5.8 | 5.8 |
试分析计算。
(1)m的值为_____。
(2)固体混合物中硫酸镁的质量分数。_____(结果保留0.1%)
(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数。_____